
����Ŀ�������������Ž��з��һ��Ԥ�Գ����Ԫ�أ��������ӹ�ҵ��������������������ͬ���壬������������������Ϊ���Ի�����ؼ��仯����Ӧ�ù㷺����ú���п�����ȡ�أ���ú���е���Ҫ�ɷ�ΪGa2O3����CaO��SiO2��Al2O3�����ʡ��ص��۵�ϵͣ�29.8�棩.�е�ܸߣ�2403�棩��
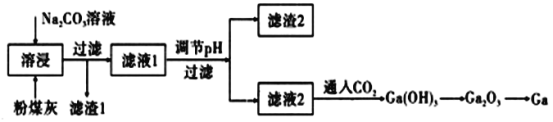
��1������1����Ҫ�ɷ�Ϊ��___________��
��2��Ϊ������ܽ�Ч�ʿ��Բ��õĴ�ʩ�У�д���֣���____________��
��3��д���ص���������������Һ��Ӧ�����ӷ���ʽ��___________��
��4�������صĻ������������ǰ�ؿƼ����й㷺Ӧ�ã�������ѧ֪ʶ�ش��������⣺
��GaCl3��Һ�Ʊ�GaCl3���壬Ӧ��β�����_________��
�ڵ�����ҵ�Ϲ�̬�����أ�GaN�����Ʊ���������������NH3��1000������ºϳɣ�ͬʱ����������ÿ����1 mol Gaʱ�ų�15.135 kJ�������ÿ��淴Ӧ���Ȼ�ѧ����ʽ��______��
��5���±�������������������ĵ��볣����

��һ�������Ͻ���ȫ�����ռ���Һ��������Ӧ�����Һ�л���ͨ��CO2����������������������____��
��6����ⷨ�����ᴿ���أ��ں�Zn��Fe��Cu�����ʣ�����NaOHˮ��ҺΪ����ʣ������������ߴ��ȵ��أ���д�������缫��Ӧ��_____����������˳��Ϊ��Zn2��<Ga3��<Fe2������
���𰸡�CaCO3��SiO2 ���¡�����(���������𰸾���) 2Ga+2OH-+2H2O=2GaO2-+3H2�� ��HCl�����м������� 2Ga(l)+ 2NH3(g)![]() 2GaN(s)+3H2(g)
2GaN(s)+3H2(g) ![]() =-30.27kJ/mol Al(OH)3 GaO2-+3e-+2H2O=Ga+4OH-
=-30.27kJ/mol Al(OH)3 GaO2-+3e-+2H2O=Ga+4OH-
��������
(1)��ú���е���Ҫ�ɷ�ΪGa2O3����CaO��SiO2��Al2O3�����ʣ�����Na2CO3��Һ�з�����ӦCaO+H2O=Ca(OH)2��Ca(OH)2+Na2CO3=CaCO3��+2NaOH��Ga2O3+2NaOH=2NaGaO2+H2O��Al2O3+2NaOH=2NaAlO2+H2O��SiO2������ˮ���ݴ˷�����
(2)����ܽ�Ч�ʿ��Բ��õĴ�ʩ�������¶ȡ�����Ӧ��Ӵ�����ȷ�����
(3)��������ѧ�������ƣ�������������Һ��Ӧ�����ӷ���ʽ��ʽҲ���ƣ�
(4)����GaCl3��Һ�Ʊ�GaCl3���壬Ҫ����Ga3+��ˮ�⣻
�ڸ�����Ŀ�е�����д���Ȼ�ѧ����ʽ��
(5)����ǿ����ԭ�����з�����
(6)����NaOHΪ����ʣ�����Ga3+ֻ����GaO2-��ʽ���ڣ��ݴ˷�����
(1)��ú���е���Ҫ�ɷ�ΪGa2O3����CaO��SiO2��Al2O3�����ʣ�����Na2CO3��Һ�з�����ӦCaO+H2O=Ca(OH)2��Ca(OH)2+Na2CO3=CaCO3��+2NaOH��Ga2O3+2NaOH=2NaGaO2+H2O��Al2O3+2NaOH=2NaAlO2+H2O��SiO2������ˮ�����˺������1ΪCaCO3��SiO2��
(2)����ܽ�Ч�ʿ��Բ��õĴ�ʩ�����¡�����ȷ�����
(3)��������ѧ�������ƣ��ص���������������Һ��Ӧ�����ӷ���ʽΪ��2Ga+2OH-+2H2O=2GaO2-+3H2����
(4)����GaCl3��Һ�Ʊ�GaCl3���壬Ϊ������Ga3+ˮ�⣬��Ҫ��HCl�����м������ɣ�
������NH3��1000�������ºϳ�GaN��ͬʱ������������ѧ����ʽΪ��2Ga+ 2NH3![]() 2GaN+3H2��ÿ����1 mol Gaʱ�ų�15.135 kJ��������÷�Ӧ���Ȼ�ѧ����ʽΪ��2Ga(l)+ 2NH3(g)
2GaN+3H2��ÿ����1 mol Gaʱ�ų�15.135 kJ��������÷�Ӧ���Ȼ�ѧ����ʽΪ��2Ga(l)+ 2NH3(g)![]() 2GaN(s)+3H2(g)
2GaN(s)+3H2(g) ![]() =-30.27kJ/mol��
=-30.27kJ/mol��
(5)��Al(OH)3��Ga(OH)3����ʽ���볣����֪��Al(OH)3�����Ը���������ǿ����ԭ������������������������Al(OH)3��������
(6)����NaOHΪ����ʣ�����Ga3+ֻ����GaO2-��ʽ���ڣ������缫��ӦΪ��GaO2-+3e-+2H2O=Ga+4OH-��


 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨij�л���A�Ľṹ��ijͬѧ��������ʵ�飺
�ٽ�2.3 g���л�����ȫȼ�գ�����0.1mol CO2��2.7gˮ��
���������Dzⶨ����Է�����������ͼ��ʾ������ͼ��

���ú˴Ź����Ǵ����û������ͼ��ʾͼ�ף�ͼ������������֮����1��2��3��

�Իش��������⣺
��1���л���A����Է���������________��
��2���л���A��ʵ��ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ĺ�ҵ�Ʊ���һ����Ҫ�Ļ����������̣���ͬʱ�����������л��������SO2����Ⱦ������Ṥҵ��β������ˮ��ʯ��ʯ����̿���Ȼ���Ϊԭ�Ͽ��Ժϳ�����Ҫ��;���ơ�����ء��Ȼ�李�������淋����ʡ��ϳ�·�����£�

���������գ�
(1)ij�糧ÿ����ú300t(ú�к������������Ϊ2.5%)����ȼ��ʱú�е���ȫ��ת��Ϊ�����������÷�Ӧ���ԭ����β���е�SO2ת��Ϊʯ�࣬�ҷ�Ӧ������96%����ת��Ϊʯ�࣬�������ʯ��______ t��
(2)����a�У�����IJ���������������___________��___________�ȣ�
(3)��Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ__________��
(4)д����Ӧ���ķ���ʽ______________ ������b������Һ�������ӵļ��鷽����________________��
(5)��Ӧ����25�棬40%�Ҷ�����Һ�н��У��ø��ֽⷴӦ��˳�����е�ԭ����___________��
(6)�����������п���ѭ��ʹ�õ�������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ӿ���ľ���ṹʾ��ͼ��ͼ�����������Ļ��ϼۿɿ�������Ϊ0�ۣ�����Ϊ��2�ۡ�������˵��������ǣ� ��

A.��������ÿ��A+���������A+��12��
B.�����У��������������Ӹ���֮��Ϊ1�U1
C.�����Ӿ��廯ѧʽΪA2O2
D.�����У�0����ԭ���멁2����ԭ�ӵ���Ŀ��Ϊ3�U1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ĺ������������࣬����Na2SO3��Na2S2O3��Na2S2O4(������������)�������ȶ��Ա���Ӧ����ǿ��
��֪��2Na2S2O4 =Na2S2O3��Na2SO3��SO2��
4H++ 2S2O42- = 3SO2��+ S�� + 2H2O
������м��㣺
(1)��Na2S2O3��Һ�벻ͬŨ�ȵ����ᷴӦ�������о�Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�졣����98%��Ũ����(�ܶ�Ϊ1.84g��cm-3)������500mL1mol��L(�ܶ�Ϊ1.06g��cm-3)��ϡ���ᣬ����ҪŨ����___________mL����ˮ_______g��
(2)��ȡ��������������������Ʒ10.16������ˮ�������Թ����������ữ�˵��Ȼ�����Һ�����ˣ�ϴ�ӣ�������ó�������Ϊ2.33�ˣ������������������_______%(��������)���������Ʊ�������
(3)����8.70g����ˮNa2S2O4����ˮ��õ�10.50g Na2S2O4��nH2O����ˮ������n��ֵ��______��
(4)Na2S2O4��500��ʱ���ַֽ�ò���A����9.16g����A�м���������ϡ�����У�����SO21.568L(��״��)����ȷ�����������ơ��������ԭ�Ӹ�����_______����ȡ��һ��Na2S2O4���ַֽ�õ��IJ���B����ag����B���ơ��������ԭ�Ӹ�����Ϊ__________(��Χ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��ԭ����������������X��Z��ͬ��Ԫ�أ�WԪ�صĵ���Ϊ����ɫ���塣���ǵ��������������ˮ�ɵ�������Һ��0.010mol��L��1����������ҺpH���Ԫ��ԭ�Ӱ뾶�Ĺ�ϵ����ͼ��ʾ������˵����ȷ����

A. W���������ˮ����һ����ǿ��
B. ��̬�⻯����ȶ��ԣ�Z>X
C. �����Ӱ뾶��W>Y
D. Y��W�γɵĻ�����һ�����й��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ѧ��ӦA2(g)��2B2(g)===2AB2(g)(AB2�ķ��ӽṹΪB��A��B)�������仯��ͼ��ʾ�������й���������ȷ����( )

A. �÷�Ӧ�Ƿ��ȷ�Ӧ
B. �÷�Ӧ�Ħ�H����(E1��E2) kJ�� mol��1
C. �÷�Ӧ�з�Ӧ��ļ����ܺʹ���������ļ����ܺ�
D. ��2 mol A(g)��4 mol B(g)�γ�4 mol A��B������E2 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��120��ʱ���������ƹ��岻�����ֽⷴӦ�������Ȼ�ϵĹ����������������ƹ����ĩ 100.00g�����ȵ�120��ʹ������ַ�Ӧ��ʣ�����91.84g����ԭ���������й������Ƶ���������Ϊ
A.38.94gB.39.78gC.38.80gD.18.72g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����ȡ����ʯ(Na3AlF6)�Ļ�ѧ����ʽ���£�2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+ 3CO2��+ 9H2O
����˵����ȷ����
A.CO2����Ϊ�����ܶѻ�����λ��Ϊ12B.AlF63-��Al3+Ϊ���壬���ܹµ��Ӷ�
C.CO32- ��CO2��C���ӻ���ʽ��ͬD.���Ӽ������HF����H2O��HF���۷е��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com