
【题目】工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
下列说法正确的是
A.CO2晶胞为分子密堆积,配位数为12B.AlF63-中Al3+为配体,接受孤电子对
C.CO32- 和CO2中C的杂化方式相同D.分子间氢键:HF大于H2O,HF的熔沸点高
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】金属镓是由门捷列夫第一个预言成真的元素,有“电子工业脊梁”的美誉,它与铝同主族,其氧化物和氢氧化物均为两性化合物,镓及其化合物应用广泛。粉煤灰中可以提取镓,粉煤灰中的主要成分为Ga2O3,含CaO、SiO2、Al2O3等杂质。镓的熔点较低(29.8℃).沸点很高(2403℃)。
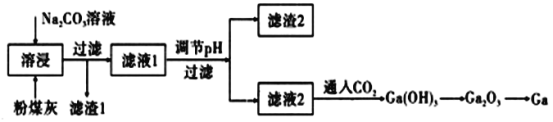
(1)滤渣1的主要成分为:___________。
(2)为了提高溶浸效率可以采用的措施有(写两种):____________。
(3)写出镓单质与氢氧化钠溶液反应的离子方程式:___________。
(4)其他镓的化合物在生活和前沿科技上有广泛应用,根据已学知识回答下列问题:
①GaCl3溶液制备GaCl3固体,应如何操作:_________。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每消耗1 mol Ga时放出15.135 kJ热量。该可逆反应的热化学方程式是______。
(5)下表是两种两性氢氧化物的电离常数。

将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是____。
(6)电解法可以提纯粗镓(内含Zn、Fe、Cu等杂质),以NaOH水溶液为电解质,在阴极析出高纯度的镓,请写出阴极电极反应:_____(离子氧化顺序为:Zn2+<Ga3+<Fe2+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )
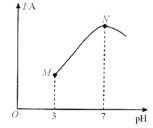
A.M点→N点,水的电离程度逐渐增大
B.25℃时,CH3COOH 的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)>c(NH4+)
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是_______________(填序号);
(2)若溶液中只有一种溶质,则该溶质为__________,该溶液中离子浓度的大小关系为_______(填序号);
(3)若关系③正确,则溶液中溶质为_________;
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显_________(填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va__________Vb(填>、<、=、无法确定)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al—PMOF其结构如图(分子式:C4H9XYZ),可快速将芥子气降解为无毒物质。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法不正确的是
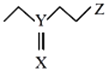
A.简单离子半径:Y>Z> XB.最简单氢化物稳定性:X >Z>Y
C.含氧酸酸性:Z>YD.YXZ2中Y的化合价为+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
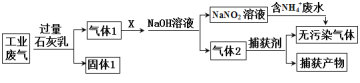
下列说法不正确的是
A.X可以是过量的空气
B.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+ 废水,每产生1mol无污染气体转移3NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是主要用于环境和物体表面消毒的含氯消毒剂,有效成分是NaClO,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2mol·L-1盐酸 | 产生少量黄绿色气体 |
② | 0.2mol·L-1KI—淀粉溶液 | 溶液变蓝 | |
③ | 0.2mol·L-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2mol·L-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的主要反应是ClO- +Cl- +2H+=Cl2↑+H2O
B.实验②中发生的主要反应是ClO- +2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱ClO- >Fe3+
D.实验④中ClO-与Al3+相互促进水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A-)+c(HA)
D.c点溶液中:c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦B.③⑤⑧C.③⑦⑧D.⑥⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com