
【题目】少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦B.③⑤⑧C.③⑦⑧D.⑥⑦⑧
【答案】C
【解析】
涉及的离子方程式:![]() ,铁少量,氢气的产量由铁决定;①加水,物质的浓度降低,反应速率减慢;②加NaOH固体,与酸结合,反应物浓度降低,氢氧化钠足够多还会降低H2的产量;③滴入几滴浓盐酸,增大了反应物的浓度,可加快反应速率;④加CH3COONa固体,与氢反应,反应物浓度降低,反应速率减慢;⑤加NaCl溶液,对反应没有任何影响,所以不能加快反应速率;⑥加入几滴硫酸铜溶液,铁与铜离子会发生氧化还原反应,构成原电池,可加快反应速率,但是铁被消耗,H2的产量会减少;⑦升高温度,可加快反应速率;⑧改用10 mL 0.1 mol/L盐酸,增大物质的浓度,反应速率加快。
,铁少量,氢气的产量由铁决定;①加水,物质的浓度降低,反应速率减慢;②加NaOH固体,与酸结合,反应物浓度降低,氢氧化钠足够多还会降低H2的产量;③滴入几滴浓盐酸,增大了反应物的浓度,可加快反应速率;④加CH3COONa固体,与氢反应,反应物浓度降低,反应速率减慢;⑤加NaCl溶液,对反应没有任何影响,所以不能加快反应速率;⑥加入几滴硫酸铜溶液,铁与铜离子会发生氧化还原反应,构成原电池,可加快反应速率,但是铁被消耗,H2的产量会减少;⑦升高温度,可加快反应速率;⑧改用10 mL 0.1 mol/L盐酸,增大物质的浓度,反应速率加快。
A.①⑥不符合题意,故A错误;
B.⑤不符合题意,故B错误;
C.③⑦⑧均符合题意,C正确;
D.⑥不符合题意,故D错误;
答案选C。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
下列说法正确的是
A.CO2晶胞为分子密堆积,配位数为12B.AlF63-中Al3+为配体,接受孤电子对
C.CO32- 和CO2中C的杂化方式相同D.分子间氢键:HF大于H2O,HF的熔沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁布给了三位为锂电池发展作出重要贡献的科学家,磷酸铁锂离子电池充电时阳极反应式为LiFePO4-xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作原理示意图如图。下列说法不正确的是
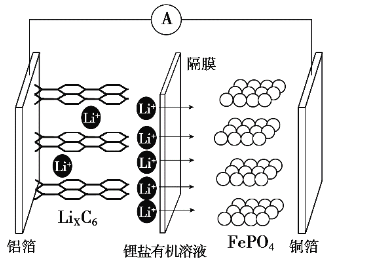
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是

A.曲线b对应的条件改变可能是加入了催化剂
B.温度T下,随着反应的进行,混合气体的密度减小
C.温度T下,该反应的平衡常数K =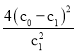
D.若曲线b对应的条件改变是温度,可判断该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是处于研究阶段的“人工固氮”的新方法。N2在催化剂表面与水发生反应:2N2(g) +6H2O(l)![]() 4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
(1)该反应平衡常数的表达式K=______________。
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时_______。
a. 平衡常数K增大 b. H2O的浓度减小
c. 容器内的压强增大 d. v逆(O2)减小
(3)部分实验数据见下表(条件:2 L容器、催化剂、光、N21 mol、水3 mol、反应时间3 h):
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组容器中3小时内以NH3表示的平均反应速率是______________。第四组容器内NH3生成量最小的可能原因是__________________。
(4)若用该反应进行工业生产,请选择适宜的条件________________。(答两条)
(5)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量,则工业合成氨的热化学方程式是_____________________。
(6)已知:N2(g)![]() 2N(g) H2(g)
2N(g) H2(g)![]() 2H(g),则断开1 mol N-H键所需的能量是_______kJ。
2H(g),则断开1 mol N-H键所需的能量是_______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的主要成分可表示为FeOCr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
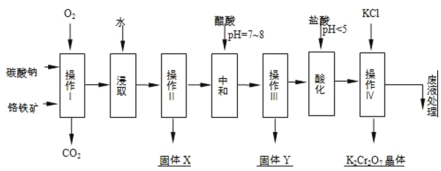
已知:
①4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是______.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有______(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是______.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、______、______、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是______.(文字说明)
物质 | 溶解度/(g/100g水) | ||||
0°C | 40°C | 80°C | |||
KCl | 28 | 40.1 | 51.3 | ||
NaCl | 35.7 | 36.4 | 38 | ||
K2Cr2O7 | 4.7 | 26.3 | 73 | ||
Na2Cr2O7 | 163 | 215 | 376 | ||
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为______(用含m、n的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验现象叙述错误的是( )
A.硫蒸汽与H2混合生成H2S
B.NH3使含酚酞的水溶液变红,加热后又恢复到无色
C.NH4Cl固体受热会发生升华
D.浓硝酸久置后颜色会变黄
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)28H2O)],并用玻璃棒搅拌,玻璃片上的水结成了冰.由此可知( )
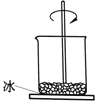
A.该反应中,化学能转变成热能
B.反应物的总能量低于生成物的总能量
C.氯化铵与氢氧化钡的反应为放热反应
D.反应的热化学方程式为 2NH4Cl+Ba(OH)2→BaCl2+2NH3H2O﹣Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com