
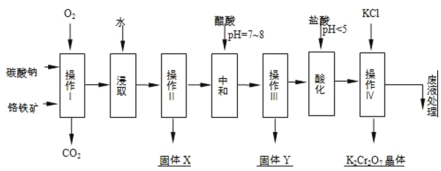
����Ŀ�����������Ҫ�ɷֿɱ�ʾΪFeOCr2O3��������MgO��Al2O3��Fe2O3�����ʣ��������Ը�����Ϊԭ���Ʊ��ظ���أ�K2Cr2O7��������ͼ��
��֪��
��4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2����
8Na2CrO4+2Fe2O3+8CO2����
��Na2CO3+Al2O3![]() 2NaAlO2+CO2����
2NaAlO2+CO2����
��������ش��������⣺
��1������I�ڳ����¸÷�Ӧ�ٶȼ��������д�ʩ����ʹ��Ӧ�����������______��
A�������¶� B��ͨ������Ŀ��� C����ԭ�Ϸ��� D�����Ӵ��������
��2������X����Ҫ����______����д��ѧʽ����
��3���ữ���������������ҺpH��5���������Ŀ����______�������ӷ���ʽ��ʾ��
��4������ iv�жಽ��ɣ����K2Cr2O7����IJ��������ǣ�����KCl���塢����Ũ����______��______��ϴ�ӡ����
��5������������ʵ��ܽ�����ݣ�������������Ӧ�Ļ�ѧ����ʽ�ǣ�Na2Cr2O7+2KCl��K2Cr2O7��+2NaCl��
�÷�Ӧ����Һ���ܷ�����������______��������˵����
���� | �ܽ��/��g/100gˮ�� | ||||
0��C | 40��C | 80��C | |||
KCl | 28 | 40.1 | 51.3 | ||
NaCl | 35.7 | 36.4 | 38 | ||
K2Cr2O7 | 4.7 | 26.3 | 73 | ||
Na2Cr2O7 | 163 | 215 | 376 | ||
��6������ƷY��Ҫ��������������������þ���������ܻ����P���������ʣ���ȷ����Y���������������ķ����dz�ȡn g��Ʒ���������______����д�Լ������ܽ⡢���ˡ���______����д�Լ����������ա���ȴ���������ø������m g��������Ʒ��������������������Ϊ______���ú�m��n�Ĵ���ʽ��ʾ����
���𰸡�ABC Fe2O3��MgO Cr2O72��+H2O�T2CrO42��+2H+ ��ȴ�ᾧ ���� K2Cr2O7���ܽ�ȱ�Na2Cr2O7С��������������K2Cr2O7���ܽ����С�� NaOH��Һ ������̼ ![]()
��������
������ͨ������4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2����Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2����Na2CO3+Al2O3![]() 2NaAlO2+CO2��������Na2CrO4��Fe2O3��MgO��NaAlO2�Ļ����ϵ��Ȼ���ˮ�ܽ⾭������ù���XΪ��Fe2O3��MgO����ҺNa2CrO4��NaAlO2���ٵ�����Һ��PH��ʹƫ��������ȫ������������õ�YΪ��������������������Һ��PHʹCrO42��ת��ΪCr2O72���������������Һ�м����Ȼ��أ�Na2Cr2O7+2KCl=K2Cr2O7��+2NaCl�������ܽ�ȼ�С��K2Cr2O7���ᾧ�õ����塣
2NaAlO2+CO2��������Na2CrO4��Fe2O3��MgO��NaAlO2�Ļ����ϵ��Ȼ���ˮ�ܽ⾭������ù���XΪ��Fe2O3��MgO����ҺNa2CrO4��NaAlO2���ٵ�����Һ��PH��ʹƫ��������ȫ������������õ�YΪ��������������������Һ��PHʹCrO42��ת��ΪCr2O72���������������Һ�м����Ȼ��أ�Na2Cr2O7+2KCl=K2Cr2O7��+2NaCl�������ܽ�ȼ�С��K2Cr2O7���ᾧ�õ����塣
(1)A�������¶ȣ����Լӿ췴Ӧ���ʣ���A��ȷ��
B��ͨ������Ŀ������������������������Լӿ췴Ӧ���ʣ���B��ȷ��
C����ԭ�Ϸ��飬�����˽Ӵ���������Լӿ췴Ӧ���ʣ���C��ȷ��
D�������ǹ��壬���漰Ũ�����⣬���Ըı䴿����������ܸı䷴Ӧ���ʣ���D����
(2)���������Ҫ�ɷֿɱ�ʾΪFeOCr2O3��������MgO��Al2O3��Fe2O3�����ʣ�����������̼���ƣ�������ӦΪ��4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2����Na2CO3+Al2O3
8Na2CrO4+2Fe2O3+8CO2����Na2CO3+Al2O3![]() 2NaAlO2+CO2����Cr2O72��+H2O2CrO42��+2H+���������ǹ��˵õ�����XΪFe2O3��MgO��
2NaAlO2+CO2����Cr2O72��+H2O2CrO42��+2H+���������ǹ��˵õ�����XΪFe2O3��MgO��
(3)�ữ�����ô��������ҺpH��5����������ͼ�����ʵ�ת�����Ʊ�Ŀ�Ŀ�֪����Ϸ�Ӧƽ��Cr2O72��+H2O2CrO42��+2H+�������ᣬ������Ũ������ƽ�����ƣ�������ʹCrO42��ת��ΪCr2O72����
(4)�������жಽ��ɣ����K2Cr2O7����IJ��������ǣ�����KCl���塢����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ����壻
(5)����ͼ�����ʵ��ܽ�ȷ����Աȣ�����������Ӧ�Ļ�ѧ����ʽ�ǣ�Na2Cr2O7+2KCl=K2Cr2O7��+2NaCl��˵��K2Cr2O7���ܽ�ȱ�Na2Cr2O7С��������������K2Cr2O7���ܽ����С����
(6)����ƷY��Ҫ��������������������þ���������ܻ����P���������ʣ���ȷ����Y���������������ķ������������������������ԣ�������������Һ�ܽ������������˵õ���Һ��ͨ������Ķ�����̼���������������������ո���õ��������������m g��������Ԫ���غ���㣬2Al(OH)3~Al2O3����Ʒ��������������������=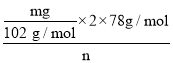 ��100%=
��100%=![]() ��
��


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ۺϴ�����NH4+ ��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣���������������̣�
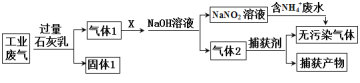
����˵������ȷ����
A.X�����ǹ����Ŀ���
B.����1����Ҫ����Ca(OH)2��CaCO3��CaSO3
C.������������������Ҫ��CO
D.������NH4+ ��ˮ,ÿ����1mol����Ⱦ����ת��3NA����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.100mol/L��NaOH��Һ�ζ�20.00ml��0.100mol/L��HNO2��Һ��lg![]() ������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ������˵���������
������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ������˵���������
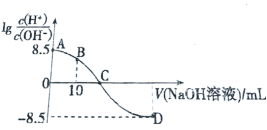
A.25��ʱ����0.100mol/L��HNO2��Һ��pHֵΪ2.75
B.B���Ӧ����Һ�У�2c(H+)+c(HNO2)=c(NO2-)+2c(OH-)
C.C���Ӧ��Һ��PH=7������NaOH��Һ�����Ϊ20.00ml
D.�ζ������д�A��D����Һ��ˮ�ĵ���̶���������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ���������������Һ�У���������ɫ���壬����Һ���Ϻ�ɫ��ȥ������һ������ԭ��Ӧ����ϵ������KCl��Cl2��ŨH2SO4��H2O��KMnO4��MnSO4��K2SO4�������ʡ����������գ�
(1)д��һ�����������������ʵ�������ԭ��Ӧ����ʽ����ƽ���������ת�Ʒ������Ŀ��___________________________��
(2)������Ӧ�У���������_____________��ÿת��1 mol���ӣ�����Cl2_____ L����״������
(3)�ڷ�Ӧ�����Һ�м���NaBiO3(��������ˮ)����Һ�ֱ�Ϊ�Ϻ�ɫ��BiO3-��Ӧ���Ϊ��ɫ��Bi3+��д����ʵ�����漰��Ӧ�����ӷ�Ӧ����ʽ��_________________��
(4)��������ʵ�飬д��������Ӧ�������������������������ǿ��˳��__________��
(5)����������ԭ��Ӧ��ϵ�У����ڵ�������Ԫ�صļ����Ӱ뾶�ɴ�С��˳��Ϊ________
(6)��ԭ�ӵ��������ӵĹ��ʽΪ___________����ԭ�Ӻ�����_______��ͬ�˶�״̬�ĵ��ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������100 mL 0.01 mol/L��ϡ���ᷴӦ����Ӧ����̫����Ϊ�˼ӿ�˷�Ӧ���ʶ����ı�H2�IJ���������ʹ�����·����е�( )
�ټ�H2O �ڼ�NaOH����۵��뼸��Ũ���� �ܼ�CH3COONa���� �ݼ�NaCl��Һ ���뼸������ͭ��Һ �������¶�(����������ӷ�) �����10 mL 0.1 mol/L����
A.�٢ޢ�B.�ۢݢ�C.�ۢߢ�D.�ޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д���������ǣ� ��
A. ʹ��̪���ɫ����Һ�У�Na����Al3����SO42����Cl��
B. ![]() =1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
=1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
C. ��Al��Ӧ�ܷų�H2����Һ�У�Fe2����K����NO3����SO42��
D. ˮ�����c(H��)=1��10��13mol��L��1����Һ�У�K����Na����AlO2����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ���ҵ�������������Ƶ����ƣ��Ʊ����Ƶķ�Ӧԭ��Ϊ��Na2SO4��s��+4H2��g��Na2S��s��+4H2O��g����Q����֪�ÿ��淴Ӧ��1000��ʱ�ﵽƽ�⣬�����ַ�Ӧ���ں��º��ݣ��Իش��������⣺
��1���˿��淴Ӧ��ƽ�ⳣ������ʽ�ɱ�ʾΪ______����ֻ�ı�һ��Ӱ�����أ���ƽ���ƶ�ʱ��Kֵ______�仯������һ����������һ����������Kֵ���ʱ���淴Ӧ����______��������������������С��������������
��2���÷�Ӧ�ﵽƽ��ʱ����˵���������______��
a��������ѹǿ���ֲ���
b��������ˮ���������ʵ���֮�ȱ��ֲ���
c����������Fe3O4���壬ƽ�����淴Ӧ�����ƶ�
d���Ƴ�����Na2S���壬ƽ��������Ӧ�����ƶ�
��3�����¶��£���2Lʢ��2.84g Na2SO4���ܱ�������ͨ��H2���壬10���Ӻ��ù�������Ϊ2.264g����10������H2��ƽ����Ӧ����Ϊ______��
��4����Ba��ClO��2��Һ��ͨ������SO2�������Һ�е�������______��
��5�������������еμӷ�̪����Һ��Ϊ��ɫ�����ڸ���Һ���ٵ��������BaCl2��Һ��������______���������ӷ���ʽ������ƽ��ԭ�����н��ͣ�______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪һ��������A��B��C��D֮���ת����ϵ����ͼ��ʾ������˵����ȷ����
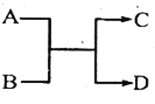
A. ��AΪFe,DΪ��������Bһ��Ϊ��
B. ��A��DΪ�����BΪˮ����Cһ�������嵥��
C. ��A��B��C��D��Ϊ������÷�Ӧһ�����ڸ��ֽⷴӦ
D. ��A��B��C��D��Ϊ10������(���ӻ�����)����C�ǿ�ʹʪ��ĺ�ɫʯ����ֽ���������壬��D������һ����Һ̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.п��ϡ���ᷴӦʱ����������CuSO4��Һ����ʹ��Ӧ���ʼӿ�
B.��NaOH�Ͱ�ˮ��Һ��ϡ��һ�������ߵ�c(OH-)����С��ԭ����![]()
C.ij��Ӧ�ġ�H=+100 kJ��mol-1,������Ӧ�Ļ�ܱ��淴Ӧ��С100 kJ/mol
D.�õ�ⷨ����ͭʱ���ô�ͭ����Ϊ���۵���������ͭƬ��Ϊ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com