
【题目】已知在120℃时,硫酸氢钠固体不发生分解反应。将均匀混合的过氧化钠与硫酸氢钠固体粉末 100.00g,加热到120℃使混合物充分反应,剩余固体91.84g,则原固体混合物中过氧化钠的质量可能为
A.38.94gB.39.78gC.38.80gD.18.72g
【答案】AD
【解析】
当过氧化钠过量时,发生反应为:①2Na2O2+2NaHSO4![]() 2Na2SO4+O2↑+2NaOH,
2Na2SO4+O2↑+2NaOH,
156 120×2 32
反应后固体减少百分比(减重率)=![]() ×100%=8.077%,
×100%=8.077%,
当硫酸氢钠部分过量,反应生成的氢氧化钠能够继续与硫酸氢钠反应生成硫酸钠和水,
总反应为:②2Na2O2+3NaHSO4![]() 3Na2SO4+O2↑+NaOH+H2O↑,
3Na2SO4+O2↑+NaOH+H2O↑,
156 360 32 18
减重率=![]() ×100%=9.69%,
×100%=9.69%,
当硫酸氢钠过量时,发生反应为:③2Na2O2+4NaHSO4![]() 4Na2SO4+O2↑+2H2O↑,
4Na2SO4+O2↑+2H2O↑,
156 480 32 36
减重率=![]() ×100%=10.69%,
×100%=10.69%,
根据题中数据可知,固体减重率=![]() ×100%=8.16%,
×100%=8.16%,
该减重率介于①②之间,即发生反应①后,生成的氢氧化钠继续与硫酸氢钠反应生成硫酸钠和水,
设参与反应①的过氧化钠为xmol,参与反应②的过氧化钠为ymol,根据混合物总质量可得:78x+120x+78y+120×1.5y=100.00,根据固体减少质量可得:32×0.5x+(18+32)×0.5y=8.16,联立解得:x≈0.4801、y≈0.0191,
混合物中过氧化钠的总物质的量为:x+y=0.4801mol+0.0191mol=0.4992mol,
过氧化钠的质量为:78g/mol×0.4992mol≈38.94g;
另外,当减重率为8.16时,有可能是硫酸氢钠过量,反应后仍然有剩余的硫酸氢钠,则混合物中过氧化钠的质量为:8.16g×![]() =18.73g,
=18.73g,
答案选AD。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、Q原子序数依次增大,Y元素最外层电子数是其电子层数的3倍,Q与Y同主族,X与Y构成的化合物可引起光化学烟雾,Z、W、Q的最高价氧化物的水化物两两之间均能发生反应。下列说法正确的是( )
A.简单氢化物的沸点:Y<QB.W的氧化物可作耐高温材料
C.简单离子半径最大的为ZD.气态氢化物的稳定性:Y<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓是由门捷列夫第一个预言成真的元素,有“电子工业脊梁”的美誉,它与铝同主族,其氧化物和氢氧化物均为两性化合物,镓及其化合物应用广泛。粉煤灰中可以提取镓,粉煤灰中的主要成分为Ga2O3,含CaO、SiO2、Al2O3等杂质。镓的熔点较低(29.8℃).沸点很高(2403℃)。
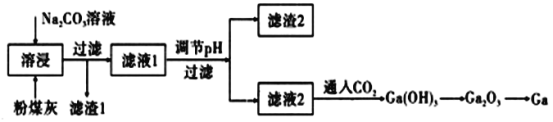
(1)滤渣1的主要成分为:___________。
(2)为了提高溶浸效率可以采用的措施有(写两种):____________。
(3)写出镓单质与氢氧化钠溶液反应的离子方程式:___________。
(4)其他镓的化合物在生活和前沿科技上有广泛应用,根据已学知识回答下列问题:
①GaCl3溶液制备GaCl3固体,应如何操作:_________。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每消耗1 mol Ga时放出15.135 kJ热量。该可逆反应的热化学方程式是______。
(5)下表是两种两性氢氧化物的电离常数。

将一块镓铝合金完全溶于烧碱溶液,再往反应后的溶液中缓缓通入CO2,最先析出的氢氧化物是____。
(6)电解法可以提纯粗镓(内含Zn、Fe、Cu等杂质),以NaOH水溶液为电解质,在阴极析出高纯度的镓,请写出阴极电极反应:_____(离子氧化顺序为:Zn2+<Ga3+<Fe2+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是
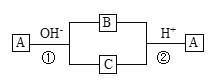
A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如右图。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法正确的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-3e-= Fe3+
B. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
C. 不鼓入空气时,正极的电极反应式为H+ + e- = H·
D. 处理含有C2O42-的污水时,上端开口应关闭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、乙二酸俗名草酸,为了测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在____________滴定管(填“酸式”或“碱式”)。
(2)本实验滴定达到终点的标志是__________________________。
(3)通过上述数据,求得x=________。
讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
II、(1)25℃时将amolL-1的氨水与0.01molL-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3H2O的电离平衡常数Kb=______
(2)25℃时,H2SO3 ![]() HSO3-+ H+的电离常数Ka = 1×10-2molL-1,则该温度下pH=3、
HSO3-+ H+的电离常数Ka = 1×10-2molL-1,则该温度下pH=3、
c(HSO3-)= 0.1molL-1的NaHSO3 溶液中c(H2SO3)=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )
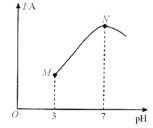
A.M点→N点,水的电离程度逐渐增大
B.25℃时,CH3COOH 的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)>c(NH4+)
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是_______________(填序号);
(2)若溶液中只有一种溶质,则该溶质为__________,该溶液中离子浓度的大小关系为_______(填序号);
(3)若关系③正确,则溶液中溶质为_________;
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显_________(填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va__________Vb(填>、<、=、无法确定)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A-)+c(HA)
D.c点溶液中:c(A-)>c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com