
【题目】硫及其化合物在工业上有着广泛的应用。完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式______
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:____Mn2++____S2O82﹣+____H2O→____MnO4﹣+____SO42﹣+______H+。配平该反应方程式,氧化产物是______
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在______(填:“阳极”或“阴极”)反应生成S2O82﹣,另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到______g氢气
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中
H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中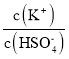 ____(填:“增大”、“减小”或“不变”)
____(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣K=1.02×10﹣7,NH4++H2ONH3H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是____(选填编号)
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3H2O+SO32﹣
【答案】S+O2![]() SO2 2 5 8 2 10 16 MnO4﹣ 阳极 0.2 HSO4﹣ SO42﹣ 减小 cd
SO2 2 5 8 2 10 16 MnO4﹣ 阳极 0.2 HSO4﹣ SO42﹣ 减小 cd
【解析】
(1)以硫磺为原料生产硫酸的过程为硫燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫和水反应生成硫酸,第一步反应的化学方程式为:S+O2![]() SO2 ;
SO2 ;
(2)反应中锰元素化合价+2价变化为+7价,电子转移5e-,S2O82-中硫元素化合价+7价变化为SO42-中硫元素化合价+6价,电子转移2e-,电子转移总数为10e-,Mn2+前系数,2,S2O82-前系数为5,结合原子守恒、电荷守恒配平书写离子方程式为:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+,反应中锰元素化合价+2价变化为+7价,做还原剂被氧化,生成氧化产物为MnO4-;
(3)用电解硫酸氢钾的方法制取过硫酸钾:阴离子在阳极失电子发生氧化反应,元素化合价分析可知硫元素化合价+6价变化为+7价,化合价升高失电子发生氧化反应生成S2O82-,HSO4-在阳极反应生成S2O82-,电极反应为:2HSO4--2e-═S2O82-+2H+,另一极生成氢气,电极反应为2H++2e-=H2↑,阳极电子守恒计算,生成0.1mol的S2O82-同时,电子转移0.2mol,S2O82-~H2↑~2e-,可收集到氢气物质的量0.1mol,质量=0.1mol×2g/mol=0.2g;
(4)已知硫酸的第二级电离并不完全,在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4-电离,溶液显酸性,则溶液中离子浓度大小为c(K+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-),则该溶液中离子浓度由大到小排列第2位的离子是HSO4-,第4位的离子是SO42-。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中c(HSO4-)、c(K+)浓度增大,但对于电离平衡,HSO4-H++SO42-,硫酸氢根离子只电离不水解,氢离子浓度增大平衡逆向进行,电离程度减小,c(HSO4-)增大的多,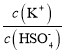 比值减小;
比值减小;
(5)已知:HSO3-H++SO32- K=1.02×10-7,NH4++H2ONH3H2O+H+ K=5.65×10-10,亚硫酸氢根离子电离程度大于NH4+的水解程度,所以亚硫酸氢铵溶液中滴入氢氧化钡溶液,氢氧根离子先和亚硫酸氢根离子反应,后与铵根离子结合生成一水合氨,反应中氢氧化钡量不同产物不同,不足量的氢氧化钡反应时需要满足化学式的组成比,
a.从选项中的离子方程式分析,HSO3-+Ba2++OH-→BaSO3↓+H2O是氢氧化钡不足量时的反应,只和亚硫酸氢根离子反应,则氢氧化钡电离出的钡离子和氢氧根离子全部反应,需要符合化学式的组成比,正确的应为2HSO3-+Ba2++2OH-→BaSO3↓+2H2O+SO32-,故a错误;
b.选项中离子方程式分析,NH4++2HSO3-+2Ba2++3OH-→2BaSO3↓+2H2O+NH3H2O,电离出2molBa2+,电离出的氢氧根离子为4mol,其中2molOH-和2mol亚硫酸氢根离子反应,2molOH-和2molNH4+离子反应,正确的反应离子方程式为:NH4++HSO3-+Ba2++2OH-→BaSO3↓+H2O+NH3H2O,故B错误;
c.依据b分析可知,选项中离子方程式为氢氧化钡和亚硫酸氢铵1:1反应的离子方程式,NH4++HSO3-+Ba2++2OH-→BaSO3↓+H2O+NH3H2O,故c正确;
d.2NH4++4HSO3-+3Ba2++6OH-→3BaSO3↓+4H2
所以选cd。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】PLLA塑料不仅具有良好的机械性能,还具有良好的可降解性。它可由石油裂解气为原料合成。下列框图是以石油裂解气为原料来合成PLLA塑料的流程图(图中有部分产物及反应条件未列出)。

请回答下列问题:
(1)属于取代反应的有______________(填编号)。
(2)写出下列反应的化学方程式:
反应③:________________________________;
反应⑤:______________________________。
(3)已知E(C3H6O3)存在三种常见不同类别物质的异构体,请各举一例(E除外)并写出其结构简式:______________________、__________________、_______________。
(4)请写出一定条件下PLLA废弃塑料降解的化学方程式___________________________。
(5)已知:![]() ,炔烃也有类似的性质,设计丙烯合成
,炔烃也有类似的性质,设计丙烯合成![]() 的合成路线_______
的合成路线_______
(合成路线常用的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1.0 mol·L-1的氨水滴入10 mL1.0 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
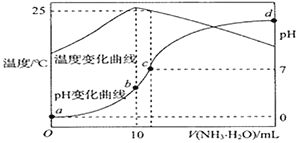
A.KW的比较:a点>b点
B.水的电离程度:a>b>c>d
C.b点时溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.c点时溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:![]() (Q>0),达到平衡后,改变一个条件,以下有关分析正确的是
(Q>0),达到平衡后,改变一个条件,以下有关分析正确的是
A.升高温度,正反应速率增大,化学平衡常数增大
B.减小压强,逆反应速率减小,化学平衡常数减小
C.加入催化剂,正逆反应速率不变,平衡不移动
D.充入氧气,正反应速率先增大后减小,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
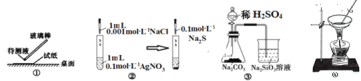
A.①用pH试纸测某溶液的酸碱性
B.实验室用图②所示装置若先出现白色沉淀后又变黑,则能比较Ksp(AgCl)﹥Ksp(Ag2S)
C.实验室用图③所示装置证明酸性:H2SO4>H2CO3>H2SiO3
D.图④可由AlCl3饱和溶液制备AlCl3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁布给了三位为锂电池发展作出重要贡献的科学家,磷酸铁锂离子电池充电时阳极反应式为LiFePO4-xLi+-xe-→xFePO4+(1-x)LiFePO4。放电工作原理示意图如图。下列说法不正确的是
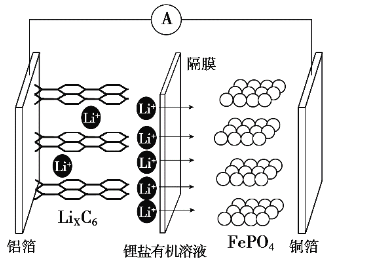
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为FePO4+xLi++xe-→xLiFePO4+(1-x)FePO4
D.磷酸铁锂离子电池充电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是处于研究阶段的“人工固氮”的新方法。N2在催化剂表面与水发生反应:2N2(g) +6H2O(l)![]() 4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
(1)该反应平衡常数的表达式K=______________。
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时_______。
a. 平衡常数K增大 b. H2O的浓度减小
c. 容器内的压强增大 d. v逆(O2)减小
(3)部分实验数据见下表(条件:2 L容器、催化剂、光、N21 mol、水3 mol、反应时间3 h):
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组容器中3小时内以NH3表示的平均反应速率是______________。第四组容器内NH3生成量最小的可能原因是__________________。
(4)若用该反应进行工业生产,请选择适宜的条件________________。(答两条)
(5)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量,则工业合成氨的热化学方程式是_____________________。
(6)已知:N2(g)![]() 2N(g) H2(g)
2N(g) H2(g)![]() 2H(g),则断开1 mol N-H键所需的能量是_______kJ。
2H(g),则断开1 mol N-H键所需的能量是_______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应能用离子反应:Ba2++2HCO3-+2OH-→BaCO3+CO32-+2H2O表示的是( )
A.Ba(OH)2与少量的NaHCO3
B.Ba(OH)2与少量的Ba(HCO3)2
C.Ba(HCO3)2与足量的NaOH
D.Ba(OH)2与足量的Ba(HCO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com