
【题目】以下物质的制备用错实验装置的是
A.苯的溴代反应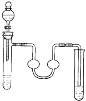 B.乙酸丁酯的制备
B.乙酸丁酯的制备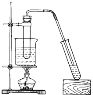
C.苯的硝化反应 ![]() D.乙炔的制取
D.乙炔的制取![]()
【答案】B
【解析】
A. 苯和液溴在溴化铁作催化剂条件下能生成溴苯,溴易挥发且有毒,溴易溶于NaOH溶液中,有缓冲装置的能防止倒吸,苯和液溴是液体、铁是固体,所以可以用分液漏斗和试管作为发生装置,中间装置能防止倒吸,用NaOH溶液吸收挥发的溴和生成的HBr,则可以实现实验目的,A正确;
B. 在浓硫酸作催化剂和加热条件下,丁醇和乙酸发生酯化反应生成乙酸丁酯,用饱和碳酸钠溶液分离乙酸丁酯,需要直接加热而不是水浴加热,B错误;
C. 苯和浓硝酸在浓硫酸作催化剂、加热55~60℃条件下制取硝基苯,温度小于100℃,需要水浴加热,C正确;
D. 实验室用饱和食盐水和碳化钙固体制取乙炔,实验可以用分液漏斗盛放液体,用烧瓶盛放碳化钙,D正确;
故合理选项是B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,中性溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存
能大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-
D.向![]() 溶液中滴加少量氯水,再加入
溶液中滴加少量氯水,再加入![]() 溶液振荡,静置,有机层呈橙色
溶液振荡,静置,有机层呈橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能
有效抑制新型冠状病毒(2019-nCoV)的感染。
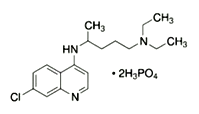
(1)已知磷酸氯喹的结构如图所示,则所含C、N、O三种元素第一电离能由大到小的顺序为_______________。P原子核外价层电子排布式为________,其核外电子有____个空间运动状态。
(2)磷酸氯喹中N原子的杂化方式为_________,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是_______________________。
(3)H3PO4中PO43- 的空间构型为________________。
(4)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ—V族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。
①磷化镓晶体中含有的化学键类型为__________(填选项字母)
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则原子2的分数坐标为______________。

③若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在工业上有着广泛的应用。完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式______
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:____Mn2++____S2O82﹣+____H2O→____MnO4﹣+____SO42﹣+______H+。配平该反应方程式,氧化产物是______
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在______(填:“阳极”或“阴极”)反应生成S2O82﹣,另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到______g氢气
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中
H++SO42﹣(Ki=1.2×10﹣2);在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是____,第4位的离子是____。往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中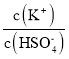 ____(填:“增大”、“减小”或“不变”)
____(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣K=1.02×10﹣7,NH4++H2ONH3H2O+H+ K=5.65×10﹣10。往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是____(选填编号)
a.HSO3﹣+Ba2++OH﹣=BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣=2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣=BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣=3BaSO3↓+4H2O+2NH3H2O+SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊酸薄荷酯(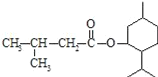 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和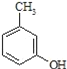 为原料制取。完成下列填空:
为原料制取。完成下列填空:
(1)制取异戊酸薄荷酯的最后一步为酯化反应,其反应物的结构简式为:______
(2) 的名称______,其属于芳香族化合物的同分异构有___种(不含
的名称______,其属于芳香族化合物的同分异构有___种(不含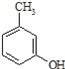 )
)
(3)制取异戊酸薄荷酯的流程中,有一步反应为: +CH3﹣CH=CH2
+CH3﹣CH=CH2![]()
 反应类型属于______反应。有机反应中通常副反应较多,实际生产中发现生成
反应类型属于______反应。有机反应中通常副反应较多,实际生产中发现生成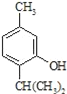 的量远大于生成
的量远大于生成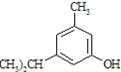 的量,试分析其原因:______
的量,试分析其原因:______
(4)甲基丙烯是重要的化工原料,请设计一条由苯和甲基丙烯通过三步反应制取化工中间体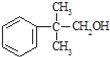 的合成线路______
的合成线路______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置制备一硝基甲苯
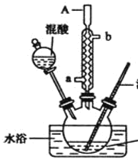 甲苯
甲苯
已知.30℃左右主要产物为一硝基甲苯,温度过高时会生成二硝基甲苯和三硝基甲苯。
实验步骤如下.
①配制浓硫酸和浓硝酸(按体积比1.3)的混合物(混酸)
②在三颈瓶里装15ml甲苯
③装好其它药品,并组装好仪器
④向三颈烧瓶中加入混酸,并不断搅拌
⑤控制温度,大约反应10min至三颈烧瓶底有大量液体(淡黄色油状)出现
⑥分离出一硝基甲苯。(已知.甲苯的密度为0.866g/ml,沸点为110.6℃,硝基苯的密度为1.20g/ml,沸点为210.9℃)
根据上述实验,回答下列问题
(1)实验方案中缺少一个必要的仪器,它是___________。本实验的关键是控制温度在30℃左右在,如果温度过高,产生的后果是_____________________________________。
(2)简述配制混酸的方法_______________________________________________________,浓硫酸的作用是______________________________。
(3)A仪器的名称是_________________进水口是________________。
(4)写出甲苯与混酸反应生成间硝基甲苯的化学方程式___________________________。
(5)分离产品方案如图所示

操作2的名称是_________________。
(6)经测定,产品1为一硝基甲苯,其核磁共拜氢谱中有3个峰,则其结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g),0~15 s内c(HI)由0.1 mol/L降到0.07 mol/L,则下列说法正确的是 ( )
H2(g)+I2(g),0~15 s内c(HI)由0.1 mol/L降到0.07 mol/L,则下列说法正确的是 ( )
A. 当HI、H2、I2浓度之比为2∶1∶1时,说明该反应达平衡
B. c(HI)由0.07 mol/L降到0.05 mol/L所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 固体表面水膜的酸性很弱或呈中性,发生吸氧腐蚀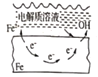
B. 钢铁表面水膜的酸性较强,发生析氢腐蚀
C. 将锌板换成铜板对钢闸门保护效果更好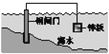
D. 钢闸门作为阴极而受到保护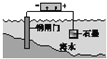
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com