
科目: 来源: 题型:
【题目】某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应,也不与氢氧化钠反应),实验步骤如下:
①配制![]() 稀盐酸和
稀盐酸和![]() 溶液各
溶液各![]()
②取一粒药片(![]() )研碎后加入
)研碎后加入![]() 蒸馏水
蒸馏水
③加入![]() 稀盐酸
稀盐酸
④用![]() 溶液中和过量盐酸,用去体积为
溶液中和过量盐酸,用去体积为![]() 。
。
请回答下列问题:
(1)测定过程中发生反应的离子方程式_________。
(2)配制上述![]() 稀盐酸所用玻璃仪器有量筒、烧杯、________。
稀盐酸所用玻璃仪器有量筒、烧杯、________。
(3)如果选用酚酞作指示剂,滴定达到终点的现象为____。
(4)某同学四次测定的![]() 数据如下:
数据如下:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 13.40 | 11.90 | 12.10 | 12.00 |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数为_____。
(5)若在实验过程中存在下列操作,会使所测碳酸钙的质量分数偏高的是_________。
a 用没有润洗的碱式滴定管装![]() 溶液进行滴定
溶液进行滴定
b 用没有润洗的酸式滴定管量取![]() 稀盐酸溶解样品
稀盐酸溶解样品
c 用![]() 溶液滴定时,开始读数平视,终点俯视
溶液滴定时,开始读数平视,终点俯视
d 装![]() 溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
溶液的滴定管,滴定前尖嘴有气泡,滴定结束后无气泡。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)![]() 溶液显酸性,试用离子方程式解释其原因________。
溶液显酸性,试用离子方程式解释其原因________。
(2)氯化银在水中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),在25C时,氯化银的![]() ,现将足量氯化银分别放入:①
,现将足量氯化银分别放入:①![]() 氯化镁溶液中,②
氯化镁溶液中,②![]() 硝酸银溶液中,③
硝酸银溶液中,③![]() 氯化铝溶液中,④
氯化铝溶液中,④![]() 盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
(3)下表所示的是常温下,某些弱酸的电离常数,请根据要求作答。
弱酸 | 电离常数 | 弱酸 | 电离常数 |
|
|
|
|
|
|
|
|
①相同物质的量浓度的![]() 和
和![]() 的混合溶液中离子浓度由大到小的顺序为_________。
的混合溶液中离子浓度由大到小的顺序为_________。
②请判断![]() 溶液显_________性(填“酸”、“碱”或“中”)。
溶液显_________性(填“酸”、“碱”或“中”)。
③下列离子方程式书写正确的是_______。
A. HC2O4-+SO32-═HSO3-+C2O42-
B. 2CH3COOH+SO32-═2CH3COO-+H2O+SO2↑
C. SO2+H2O+2CH3COO-═2CH3COOH+SO32-
D. 2CO32-+SO2+H2O═2HCO3-+SO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.回答下列问题:
(1)烃A的结构简式为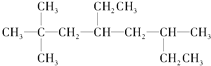 ,用系统命名法命名烃A:____________。
,用系统命名法命名烃A:____________。
(2)某烃的分子式为![]() ,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为: ,下列各物质:A.
,下列各物质:A. 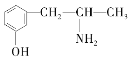 B.
B. ![]() C.
C. 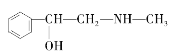 D.
D. 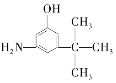 E.
E. 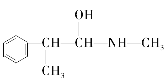
与麻黄素互为同分异构体的是_________(填字母,下同),互为同系物的是___________(填字母)。
Ⅱ.有机物C常用于食品行业。已知![]() 在足量
在足量![]() 中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重
中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重![]() 和
和![]() ,经检验剩余气体为
,经检验剩余气体为![]() 。
。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_______。
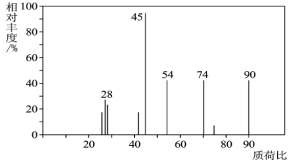
(2)C能与![]() 溶液发生反应,C一定含有的官能团是_____________。
溶液发生反应,C一定含有的官能团是_____________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是![]() ,则C的结构简式是________。
,则C的结构简式是________。
(4)![]() 与
与![]() 的氢氧化钠溶液反应,需溶液的体积是_____
的氢氧化钠溶液反应,需溶液的体积是_____![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大。其中A为d元素组成的非金属单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物,常温下乙为液体。下列说法正确的是( )

A.简单离子半径:c>b
B.反应①为吸热反应
C.②反应中氧化剂与还原剂物质的量之比为1:1
D.b、d分别与a形成的化合物中,化学键类型一定完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.回答下列问题:
(1)量子力学把电子在原子核外的一个空间运动状态称为一个________,还有一种状态叫做________。
(2)写出![]() 原子的外围电子排布式:______,其在周期表中的位置________,其在周期表中处于______区,与
原子的外围电子排布式:______,其在周期表中的位置________,其在周期表中处于______区,与![]() 同周期的所有副族元素的基态原子中,最外层电子数与
同周期的所有副族元素的基态原子中,最外层电子数与![]() 相同的元素有_________种。
相同的元素有_________种。
(3)下列![]() 原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
A 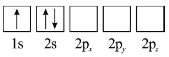 B
B 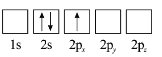
C 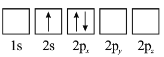 D
D 
Ⅱ.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层![]() 能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成
能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成![]() 型化合物,并知在
型化合物,并知在![]() 中,
中,![]() 与
与![]() 的质量比为
的质量比为![]() 原子的价电子排布式为
原子的价电子排布式为![]() 。根据以上条件,回答下列问题:
。根据以上条件,回答下列问题:
(1)C的基态原子的电子占据最高能层的符号为_______,![]() 原子的价电子排布图________。
原子的价电子排布图________。
(2)A、B、C三种元素的第一电离能由大到小的顺序______(用元素符号表示)。
(3)元素B和D的电负性由大到小的顺序_________(用元素符号表示)。
(4)写出E的元素符号_________,要证明太阳光中含有E元素,可采用的方法是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.合成氨工业中,每生产![]() ,放出
,放出![]() 热量。
热量。
(1)写出合成氨反应的热化学方程式___________。
(2)已知:

![]() 键断裂吸收的能量等于_______
键断裂吸收的能量等于_______![]() (计算结果取整数)。
(计算结果取整数)。
Ⅱ.人工肾脏可用间接电化学方法除去代谢产物中的尿素[化学式为![]() ],原理如图。
],原理如图。
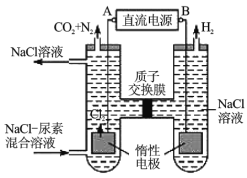
(1)电源的负极为__________(填“A”或“B”)。
(2)阳极室中发生的反应依次为_________,_________。
(3)电解结束后,阴极室溶液的![]() 与电解前相比将__________(填“增大”、“减小”或“不变”)。
与电解前相比将__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为:![]() +CO2
+CO2![]() 。下列说法错误的是( )
。下列说法错误的是( )
A.上述反应属于加成反应
B.碳酸亚乙酯的所有二氯代物中均存在手性碳原子
C.碳酸亚乙酯中的所有氧原子处于同一平面内
D.1mol碳酸亚乙酯最多可消耗2molNaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:
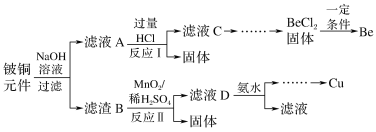
已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有__(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为__(填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是__。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:__。
②若用浓HNO3溶解金属硫化物,缺点是__(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是__(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于__。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
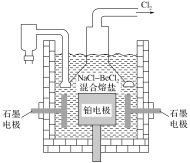
①石墨电极上的电极反应式为__。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为__。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的
溶液,混合溶液的![]() 变化情况如图中所示曲线(体积变化忽略不计)。下列叙述正确的是( )
变化情况如图中所示曲线(体积变化忽略不计)。下列叙述正确的是( )
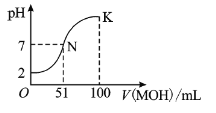
A.![]() 溶液的
溶液的![]() B.
B.![]() 点时加水稀释溶液,
点时加水稀释溶液,![]() 减小
减小
C.在![]() 点,
点,![]() D.在
D.在![]() 点,
点,![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com