
科目: 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.11g基态硼原子含有的未成对电子数为3NA
B.1mol基态氟原子能量最高的能级上电子数为7NA
C.100mL1molL-l亚硫酸钠溶液含有的阴离子数目大于0.1NA
D.电解法精炼铜,阴极析出64gCu时,阳极转移的电子数大于2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
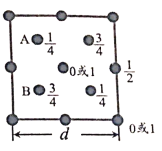
查看答案和解析>>
科目: 来源: 题型:
【题目】α-Fe(Ⅲ)铁原子簇是合成氨工业的新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为:①H2(g)═2H(g) △H1,②N2(g)+2H(g)![]() 2(NH)(g) △H2,③NH(g)+H(g)
2(NH)(g) △H2,③NH(g)+H(g)![]() (NH2) △H3,④(NH2)(g)+H(g)
(NH2) △H3,④(NH2)(g)+H(g)![]() NH3(g) △H4,总反应为N2(g)+3H2(g)
NH3(g) △H4,总反应为N2(g)+3H2(g)![]() 2NH3(g) △H。下列说法正确的是( )
2NH3(g) △H。下列说法正确的是( )
A.△H═3△H1+△H2+2△H3+2△H4
B.催化剂能够有效降低反应的活化能并改变反应的焓变
C.反应①和总反应均为放热反应
D.增大压强和使用高效催化剂均有利于提高反应②③④的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
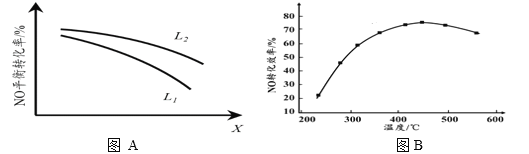
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关描述及化学用语的表示方法正确的是( )
A.原子核内有8个中子的基态碳原子价电子排布图为:![]()
B.NH4F的电子式为:![]() ,三种元素中氟的第一电离能最大
,三种元素中氟的第一电离能最大
C.铜属于d区元素,溴属于p区元素,二者基态原子未成对电子数目相同
D.CO2分子的结构式为:O=C=O,碳的原子半径大于氧的原子半径
查看答案和解析>>
科目: 来源: 题型:
【题目】银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。回答下列问题:
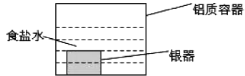
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于__________腐蚀(填“化学”或“电化学”)。
(2)铝质容器作为__________极,银器的电极反应式为____________。
(3)处理过程中总反应的化学方程式为_______________。
(4)若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
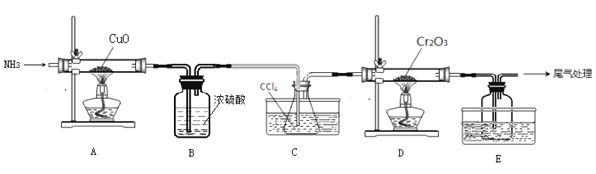
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ·mol-1
2NO(g) △H=+180 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=-564 kJ·mol-1
2CO2(g) △H=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=___________。
2CO2(g)+N2(g) △H=___________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示。

①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=2MPa,则T℃时该反应的压力平衡常数Kp=___________;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,平衡将___________ (填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是___________(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
II.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为___________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为___________g。

查看答案和解析>>
科目: 来源: 题型:
【题目】水是生命之源,万物之基。不仅如此,水在化学中的作用也不可忽视。
I.常温下,浓度均为0.l mol·L-1的下列五种水溶液的pH如下表:
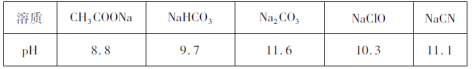
(1)上述盐溶液中的阴离子,结合质子能力最强的是__________。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最弱的是__________;将各溶液分别加水稀释100倍,pH变化最大的是__________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
(3)要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为__。
II.已知水在25℃和95℃时,其电离平衡曲线如图所示:
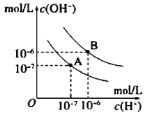
(1)95℃时水的电离平衡曲线应为__________(选填“A”或“B”);
(2)25℃时,将pH=10的NaOH溶液与pH=6的盐酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸溶液的体积比为__________;
(3)95℃时,若1体积pH=a的某强酸溶液与10x体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com