
科目: 来源: 题型:
【题目】在工业废气和汽车尾气中含有多种氮氧化物,主要是NO 和NO2,都以NOx来表示。NOx能破坏臭氧层,产生光化学烟雾,是造成大气污染的主要来源之一。回答下列问题:
(1)已知 1mol 分子分解为单个原子所需要的能量为解离焓。 N2(g)、NO(g)、O2(g)的解离焓分别为941.7、631.8、493.7(单位kJ/mol),计算反应 2NO(g) = N2(g) + O2(g)的△H=_______kJ/mol,试判断NO(g)常温、常压下能否自发分解 ________填能或不能)。
(2)为防止光化学烟雾,除从工厂、汽车的设计进行改进外,也要采用某些化学方法。用焦炭还原NOx 的反应为2NOx(g) + xC(s)N2(g) + xCO2(g)
Ⅰ.在恒温条件下,2 molNO2(g)和足量 C(s)反应,测得平衡时 NO2(g)和 CO2(g)的物质的量浓度与平衡总压的关系如图所示:
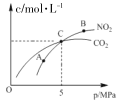
①A、B两点NO2平衡转化率的关系α(A)____α(B),平衡常数关系K(A)_____K(B)(填>、<或=)。
②计算C点时该反应的压强平衡常数Kp=_____MPa(Kp是用平衡分压代替平衡浓度)计算,分压=总压×物质的量分数)。
Ⅱ.现在向容积均为 2L 的两个密闭容器A、B中加入一定量的 NO(g)和足量的C(s),相同温度下测得两容器中n(NO)随时间变化情况如表所示:
0 | 20 | 40 | 60 | 80 | |
n(NO)/mol(A) | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
n(NO)/mol(B) | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
B容器内反应在 100s时达到平衡状态,则0~100s内用 NO 表示的平均反应速率为v(NO)= ____________。
(3)近年来电化学方法在处理氮氧化物方面也起到了一定的作用,如图是一种氨气一二氧化氮燃料电池,常温下可将二氧化氮转化为氮气。

①c口通入的气体为______ ,写出负极反应的方程式 ________。
②若a、d口产生的气体体积共为1.568L(标况下),电路中通过的电子数为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目: 来源: 题型:
【题目】孔雀石是含铜的碳酸盐矿物,主要成分为 Cu2(OH)2CO3,工业上以孔雀石(主要杂质有FeCO3、FeO、SiO2)制备胆矾的一般流程如下:
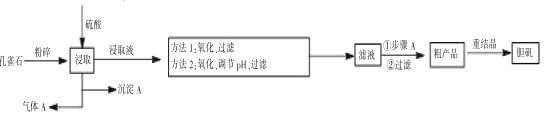
注:重结晶目的是为了除尽Fe3+
回答下列问题:
(1)写出气体A 的电子式______________。
(2)方法 1 的原理是用微酸性的高锰酸钾溶液将二价铁氧化为 Fe(OH)3,使之与 MnO2 共沉淀,易于过滤,除铁效果好,稍有过量,溶液即显微红色,便于掌握。稍过量的高锰酸钾会自动分解,产生 MnO2 和一种无毒的气体,请完善此反应的离子反应方程式:_____MnO4- +________H+ = __MnO2↓ + ____+ _____
(3)方法 1 的不足之处是在酸性条件下会发生副反应__________________ (写出离子方程式),产物Mn2+进入溶液,需要后续步骤除去,同时 Fe3+水解也不易彻底。因而实际生产中更多采用的是方法 2,用过氧化氢作为氧化剂,优点是____。氧化后调节pH 沉淀出氢氧化铁,但需注意pH 不可过高,否则造成的影响是_____。
(4)若在实验室进行步骤A 操作,需要用到的硅酸盐仪器有 _________________ 。
(5)CuSO4·5H2O 含量的测定:称取 0.5g 样品,溶于水,移入 100mL 容量瓶中,稀释至刻度,量取 25.00mL,稀释至 100mL,加入10mL 氨-氯化铵缓冲溶液(pH=10)及 0.2g 红紫酸铵混合指示剂,摇匀,用浓度为 cmol·L-1 EDTA 标准溶液滴定至溶液呈紫蓝色不变,重复三次,平均消耗的标准溶液体积为VmL。 (EDTA 能与大多数金属离子形成稳定的 1:1 络合物,是络合滴定中的常用滴定试剂)
①计算CuSO4·5H2O 质量分数 ______________。
②若不进行重结晶操作,计算出的质量分数结果会__________。(填偏低、偏高或者无影响)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某模拟“人工树叶“的电化学实验装置如图所示,该装置能将H2O和CO2转化为 O2和燃料(C3H8O),下列说法不正确的是( )
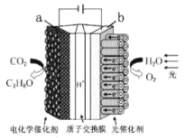
A.该装置工作时,H+从b极区向a极区迁移
B.a电极的反应为:3CO2+18H++18e-= C3H8O +5H2O
C.每生成1moO2, 有44g CO2被还原
D.C3H8O形成燃料电池以氢氧化钠溶液作为电解质溶液的负极反应式C3H8O-18H++24OH-=3CO32-+16H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )


A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:pOH= -lgc(OH-)。298 K时,向20.00 mL0.10mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
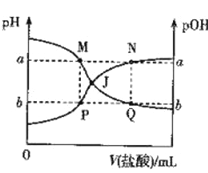
A. 曲线PJN表示溶液中PH的变化
B. M点水的电离程度比Q点大
C. M、P两点的数值之和a + b = 14
D. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A. AgNO3 [AgNO3] B. NaOH [H2O]
C. KCl [KCl] D. CuSO4 [Cu(OH)2]
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质)。下列说法正确的是

A. 电解一段时间后,阴极和阳极消耗的气体的物质的量之比为l:2
B. 石墨l极发生的电极反应为2CH3OH+CO-e-=(CH3O)2CO+H+
C. 石墨2极与直流电源正极相连
D. H+由石墨2极通过质子交换膜向石墨l极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E 为原子序数依次增大的短周期元素。A、C处于同一主族,C、D、E 处于同一周期,E 原子的最外层电子数是 A、B、C原子最外层电子数之和。A、B 组成的常见气体 X 能使湿润的红色石蕊试纸变蓝;D 的单质既能与C元素最高价氧化物的水化物的溶液反应生成盐,也能与A、E 形成的化合物的水溶液反应生成盐。下列说法正确的是( )
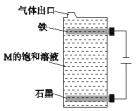
A.原子半径的大小顺序:C>D>E>A>B
B.C、E组成的化合物M 用右图装置进行电解能得到大量的 E 单质
C.元素B、E的最高价氧化物对应的水化物的酸性:B>E
D.C元素的氧化物中阴、阳离子数目之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com