
科目: 来源: 题型:
【题目】页岩气中含有较多的乙烷,可将其转化为更有工业价值的乙烯。
(1) 二氧化碳氧化乙烷制乙烯。
将C2H6和CO2按物质的量之比为1∶1通入反应器中,发生如下反应:
ⅰ.C2H6(g) ![]() C2H4(g) + H2(g) ΔH1=+136.4 kJ·mol 1
C2H4(g) + H2(g) ΔH1=+136.4 kJ·mol 1
ⅱ.CO2(g) + H2(g) ![]() CO(g) + H2O(g) ΔH2=+41.2 kJ·mol 1
CO(g) + H2O(g) ΔH2=+41.2 kJ·mol 1
ⅲ.C2H6(g) +CO2(g) ![]() C2H4(g) +CO(g) +H2O(g) ΔH3
C2H4(g) +CO(g) +H2O(g) ΔH3
①用ΔH1、ΔH2计算ΔH3=______kJ·mol1。
②反应ⅳ:C2H6(g) ![]() 2C(s)+3H2(g)为积碳反应,生成的碳附着在催化剂表面, 降低催化剂的活性,适当通入过量 CO2 可以有效缓解积碳,结合方程式解释其原因:__。
2C(s)+3H2(g)为积碳反应,生成的碳附着在催化剂表面, 降低催化剂的活性,适当通入过量 CO2 可以有效缓解积碳,结合方程式解释其原因:__。
③二氧化碳氧化乙烷制乙烯的研究热点之一是选择催化剂,相同反应时间,不同温度、不同催化剂的数据如下表(均未达到平衡状态):

(注)C2H4 选择性:转化的乙烷中生成乙烯的百分比。
CO 选择性:转化的 CO2 中生成 CO 的百分比。
对比Ⅰ和Ⅱ,该反应应该选择的催化剂为__,理由是__。实验条件下,铬盐作催化剂时,随温度升高,C2H6 的转化率升高,但 C2H4 的选择性降低,原因是__。
(2) 利用质子传导型固体氧化物电解池将乙烷转化为乙烯,示意图如图:
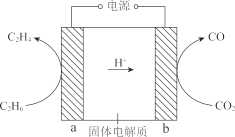
①电极 a 与电源的______极相连。
②电极 b 的电极反应式是 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为__________。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=______________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=______________。
②该反应的△H________0(填“>”或“<”) ,理由是____________________。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl
NHCl2(l)+2HCl(g),测得平衡时Cl

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目: 来源: 题型:
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用 Na2SiO3 溶液制备硅酸。某小组同学进行了如下实验:
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
下列结论不正确的是
A.Na2SiO3 溶液一定显碱性
B.由 Ⅰ 不 能 说 明 酸 性 H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时 Na2CO3 溶液的碱性强于 NaHCO3 溶液
D.向 Na2SiO3 溶液中通入过量 CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家侯德榜发明的“侯氏制碱法”联合合成氨工业生产纯碱和氮肥,工艺流程图如下。碳酸化塔中的反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。

下列说法不正确的是
A.以海水为原料,经分离、提纯和浓缩后得到饱和氯化钠溶液进入吸氨塔
B.碱母液储罐“吸氨”后的溶质是NH4Cl和NaHCO3
C.经“冷析”和“盐析”后的体系中存在平衡 NH4Cl(s) ![]() NH4+(aq) + Cl-(aq)
NH4+(aq) + Cl-(aq)
D.该工艺的碳原子利用率理论上为 100%
查看答案和解析>>
科目: 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12mol σ键的K4[Fe(CN)6的物质的量为________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(4)Fe、Na、K的晶体结构如图所示:
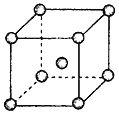
① 钠的熔点比钾更高,原因是__________________________。
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,向 20 mL 0.1 mol·L 1 的两种酸 HA、HB 中分别滴加 0.1 mol·L 1NaOH 溶液, 其 pH 变化分别对应下图中的Ⅰ、Ⅱ。下列说法不正确的是

A.向 NaA 溶液中滴加 HB 可产生 HA
B.a点,溶液中微粒浓度:c(A-) > c(Na+) > c(HA)
C.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)= c(B-)
D.滴加 20 mL NaOH 溶液时,Ⅰ中 H2O 的电离程度大于Ⅱ中
查看答案和解析>>
科目: 来源: 题型:
【题目】光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为 H+和 OH-,并实现其定向通过。下列说法不正确的是

A.该装置将光能转化为化学能并分解水
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.再生池中的反应: 2V2+ +2H2O  2V3++2OH-+H2↑
2V3++2OH-+H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:2Zn(s) + O2(g) =2ZnO(s) ΔH1=-702.2kJ/mol
Hg(l) + ![]() O2(g) =HgO(s) ΔH2=-90.7kJ/mol
O2(g) =HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3 ,其中ΔH3的值是( )
A. -260.4 kJ/mol B. -254.6 kJ/mol
C. -438.9 kJ/mol D. -441.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com