
【题目】室温时,向 20 mL 0.1 mol·L 1 的两种酸 HA、HB 中分别滴加 0.1 mol·L 1NaOH 溶液, 其 pH 变化分别对应下图中的Ⅰ、Ⅱ。下列说法不正确的是

A.向 NaA 溶液中滴加 HB 可产生 HA
B.a点,溶液中微粒浓度:c(A-) > c(Na+) > c(HA)
C.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)= c(B-)
D.滴加 20 mL NaOH 溶液时,Ⅰ中 H2O 的电离程度大于Ⅱ中
【答案】C
【解析】
A.由图可知,0.1 mol·L 1HB溶液的pH小于等浓度的HA溶液,说明HB的酸性强于HA,由强酸制弱酸的原理可知,向 NaA 溶液中滴加 HB 可产生 HA,故A正确;
B. 由图可知,a点为等浓度的HA和NaA混合液,溶液呈酸性,说明HA的电离大于NaA的水解,则溶液中微粒浓度:c(A-)>c(Na+)>c(HA),故B正确;
C.由于HB的酸性强于HA,等浓度的HB溶液和HA溶液滴加NaOH溶液 pH=7 时,消耗NaOH溶液的体积不同,溶液中钠离子的不同,则两种溶液中 c(A-)一定不等于c(B-),故C错误;
D. 滴加 20 mL NaOH 溶液时,等浓度的HB溶液和HA溶液均恰好完全反应生成NaB和NaA,由于HB的酸性强于HA,则NaA的水解程度大于NaB,Ⅰ中 H2O 的电离程度大于Ⅱ中,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
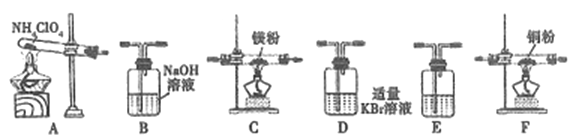
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:

步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型非氯高效消毒剂,微溶于KOH溶液,热稳定性差。实验室制备高铁酸钾的原理为3Cl2+2Fe(OH)3+10KOH==2K2FeO4+6KCl++8H2O。下列实验设计不能达到实验目的的是
A.用图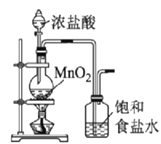 所示装置制备并净化氯气
所示装置制备并净化氯气
B.用图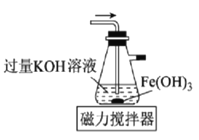 所示装置制备高铁酸钾
所示装置制备高铁酸钾
C.用图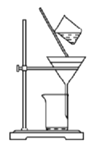 所示装置分离出高铁酸钾粗品
所示装置分离出高铁酸钾粗品
D.用图 所示装置干燥高铁酸钾
所示装置干燥高铁酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是
A | B | C | D |
|
|
|
|
烧杯中产生白色沉淀,一段时间后沉淀无明显变化 | 加盐酸出现白色浑浊,加热变澄清 | KMnO4 酸性溶液在苯和甲苯中均褪色 | 液体分层,下层呈 无色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出由 WO3 催化乙烯和 2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
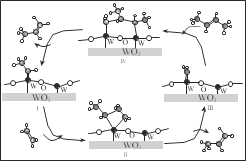
A.乙烯、丙烯和 2-丁烯互为同系物
B.乙烯、丙烯和 2-丁烯的沸点依次升高
C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式结构
D.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)可用作抗氧剂等,工业上常用尿素[CO(NH2)2]和 NaClO溶液反应制备水合肼。
已知:Ⅰ.N2H4·H2O 的结构如图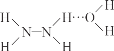 (…表示氢键)。
(…表示氢键)。
Ⅱ.N2H4·H2O 沸点 118 ℃,具有强还原性。
(1)将 Cl2 通入过量 NaOH 溶液中制备 NaClO,得到溶液 X,离子方程式是__。
(2)制备水合肼:将溶液 X 滴入尿素水溶液中,控制一定温度,装置如图 a(夹持及控温装置已略)。充分反应后,A 中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品 NaCl 和Na2CO3·10H2O。

①A 中反应的化学方程式是__。
②冷凝管的作用是__。
③若滴加 NaClO 溶液的速度较快时,水合肼的产率会下降,原因是__。
④NaCl 和 Na2CO3 的溶解度曲线如图 b。由蒸馏后的剩余溶液获得 NaCl 粗品的操作是__。
(3)水合肼在溶液中可发生类似 NH3·H2O 的电离,呈弱碱性;其分子中与 N 原子相连的 H 原子易发生取代反应。
①水合肼和盐酸按物质的量之比 1∶1 反应的离子方程式是__。
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与 DEC( ![]() )发生取代反应制得。碳酰肼的结构简式是__。
)发生取代反应制得。碳酰肼的结构简式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
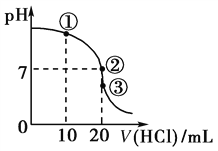
A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下能大量共存的是( )
A.由水电离产生的c(H+)=1×10-10molL-1的溶液中:NO3-、Fe2+、Na+、SO42-
B.![]() =10-10molL-1的溶液中:NH4+、I-、Cl-、K+
=10-10molL-1的溶液中:NH4+、I-、Cl-、K+
C.![]() =1×106的溶液中:K+、Na+、Cl-、HCO3-
=1×106的溶液中:K+、Na+、Cl-、HCO3-
D.惰性电极电解AgNO3后的溶液中:SO32-、K+、Na+、S2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com