
【题目】高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
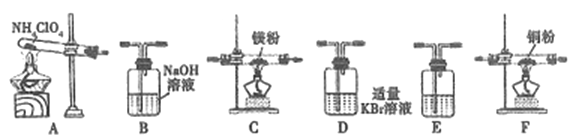
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:

步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
【答案】2NH4ClO4![]() 2O2↑+N2↑+Cl2↑+4H2O↑
2O2↑+N2↑+Cl2↑+4H2O↑ ![]() 浓硫酸 E、F、C D裝置中颜色由无色变为橙色 85.0或85 酸式滴定管或移液管 用NaOH标准溶液标定硫酸溶液的浓度
浓硫酸 E、F、C D裝置中颜色由无色变为橙色 85.0或85 酸式滴定管或移液管 用NaOH标准溶液标定硫酸溶液的浓度
【解析】
试题(1)根据得失电子守恒配平高氯酸铵受热分解的化学反应方程式;Mg3N2是离子化合物;(2)A是高氯酸铵受热分解的装置;B是氢氧化钠溶液,可以吸收氯气;C中盛放Mg粉,可以检验氮气;D中溴化钾可以检验氯气;F中铜粉可以检验氧气;E中盛放液体,根据E装置质量的增加来验证生成的水,所以E中盛浓硫酸;(3) ①根据硫酸体积的精度是0.01mL选择仪器;②要计算NH4ClO4的含量,需要知道硫酸溶液的浓度。
解析:(1)根据得失电子守恒配平高氯酸铵受热分解的化学反应方程式为2NH4ClO4![]() 2O2↑+N2↑+Cl2↑+4H2O↑;Mg3N2是离子化合物,电子式是
2O2↑+N2↑+Cl2↑+4H2O↑;Mg3N2是离子化合物,电子式是![]() ;(2)①A是高氯酸铵受热分解的装置;B是氢氧化钠溶液,可以吸收氯气;C中盛放Mg粉,可以检验氮气;D中溴化钾可以检验氯气;F中铜粉可以检验氧气;E中盛放液体,根据E装置质量的增加来验证生成的水,所以E中盛浓硫酸;②根据以上分析,按气流由左至右的方向连接装置:A →E→D →B→E→F→C→E;③D中溴化钾可以与氯气反应,方程式是
;(2)①A是高氯酸铵受热分解的装置;B是氢氧化钠溶液,可以吸收氯气;C中盛放Mg粉,可以检验氮气;D中溴化钾可以检验氯气;F中铜粉可以检验氧气;E中盛放液体,根据E装置质量的增加来验证生成的水,所以E中盛浓硫酸;②根据以上分析,按气流由左至右的方向连接装置:A →E→D →B→E→F→C→E;③D中溴化钾可以与氯气反应,方程式是![]() ,溴水为橙色,所以D裝置中颜色由无色变为橙色可以证明产物中有Cl2;④C中盛放Mg粉,可以与氮气反应生成Mg3N2,若C装置质量增加了2.38g,说明反应生成氮气2.38g,则NH4ClO4的分解率是
,溴水为橙色,所以D裝置中颜色由无色变为橙色可以证明产物中有Cl2;④C中盛放Mg粉,可以与氮气反应生成Mg3N2,若C装置质量增加了2.38g,说明反应生成氮气2.38g,则NH4ClO4的分解率是![]() ;(3) ①根据硫酸体积的精度是0.01mL,准确量取40.00ml H2SO4 溶液的玻璃仪器是酸式滴定管;②为获得样品中NH4ClO4的含量,还需补充的实验是用NaOH标准溶液标定硫酸溶液的浓度。
;(3) ①根据硫酸体积的精度是0.01mL,准确量取40.00ml H2SO4 溶液的玻璃仪器是酸式滴定管;②为获得样品中NH4ClO4的含量,还需补充的实验是用NaOH标准溶液标定硫酸溶液的浓度。


科目:高中化学 来源: 题型:
【题目】工业上以硫酸泥(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)为原料提取硒,流程如图:

(1)“脱硫”过程中,温度控制在95℃,原因是___。
(2)“氧化”过程中,Se转化成H2SeO3,该反应的化学方程式为___。
(3)“还原”过程是通过控制电位还原的方法将电位高的物质先还原,电位低的物质保留在溶液中。下表是将“过滤Ⅰ”所得滤液中所含物质还原对应的电位。控制电位在0.782~1.692V,可除去“过滤Ⅰ”所得滤液中残留的ClO2。
名称 | Cu2+/Cu | Zn2+/Zn | Fe2+/Fe | Fe3+/Fe2+ | ClO2/Cl- | H2SeO3/Se |
电位/V | 0.435 | -0.885 | -0.463 | 0.782 | 1.692 | 0.743 |
为使硒和杂质金属分离,加入Na2SO3还原时,电位应控制在___范围;H2SeO3(弱酸)还原为硒的离子反应方程式为___。
(4)滤液Ⅱ中主要存在的金属阳离子有Zn2+、Na+、___。
(5)所得粗硒需精制。向粗硒浸出液中加入Na2S溶液可以将残留的Fe2+等微量杂质离子转化为沉淀而除去。已知25℃时Ksp(FeS)=6.0×10-18,要使溶液中Fe2+沉淀完全[c(Fe2+)≤1.0×10-5mol·L-1],则需控制溶液中c(S2-)≥___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃时,K=1,今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列说法不正确的是( )
A.900℃,该反应的平衡常数K<1
B.850℃达到平衡时,通入CO,CO转化率将增大
C.850℃时,若x=5.0,则起始时平衡向逆反应方向移动
D.850℃时,若要使上述反应开始时向正反应方向进行,则![]() 应满足0≤x<3
应满足0≤x<3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
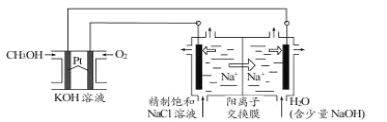
(1)CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH______(填“增大”、“减小”或“不变”),负极反应式为______。
(2)图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。阳极产生ClO2的反应式为______。
(3)电解一段时间,从阴极处收集到的气体比阳极处收集到气体多6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为______mol。
(4)在阴极室中加入少量的NaOH的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表
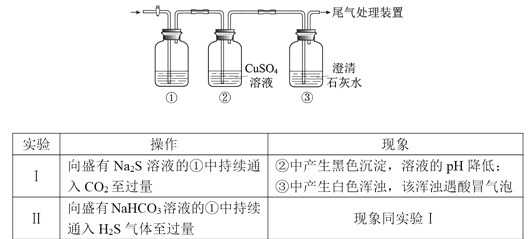
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A.③中白色浑浊是CaCO3
B.②中溶液pH降低的原因是:H2S+Cu2+=CuS↓+2H+
C.实验①中CO2过量发生的反应是:CO2+H2O+S2-=CO32-+H2S
D.由实验I和II不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均为C8H8,下列说法不正确的是
(丙)的分子式均为C8H8,下列说法不正确的是
A. 甲、乙、丙在空气口燃烧时均产生明亮并带有浓烟的火焰
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物数目最少的是丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生为探究苯与溴发生反应的原理,用如图所示装置进行了实验。根据相关知识回答下列问题:

(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在装置Ⅲ中可能观察到的现象是______________________________________。
(2)整套实验装置中能防止倒吸的装置有___________________________(填装置序号)。
(3)写出装置Ⅱ中发生反应的化学方程式:_____________________________________。
(4)本实验能不能用溴水代替液溴?___________________________________________。
(5)采用冷凝装置,其作用是_________________________________________________。
(6)Ⅲ装置中小试管内苯的作用是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Wilson病是一种先天性铜代谢障碍性疾病,D-青霉胺具有排铜作用,用以治疗或控制Wilson病症。D-青霉胺结构简式如图:
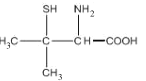
回答下列问题:
(1)写出Cu的简化电子排布式________。
(2)已知气态基态原子得到一个电子形成气态基态负一价离子所产生的能量变化称为该元素原子的第一电子亲合能(吸收能量为负值,释放能量为正值),试解释碳原子第一电子亲合能较大的原因 _________。 第一电子亲合能可能为正值或负值,而第二电子亲合能均为负值,原因是_____。
(3)D-青霉胺中,硫原子的VSEPR模型为____,碳原子的杂化方式为_______。
(4)请简述D-青霉胺能溶于水的主要原因________。
(5)青霉胺在临床治疗时对于症状改善较慢,常有并发症出现,因而近年采用锌剂(ZnSO4)替代治疗,可由硫化锌制备。立方硫化锌晶胞与金刚石晶胞类似,结构如图
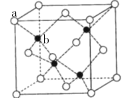
其中a代表S2-,b代表Zn2+。则该晶胞中S2-的配位数为______,若晶体的密度为ρg·cm-3,则晶胞的体积为________ cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向 20 mL 0.1 mol·L 1 的两种酸 HA、HB 中分别滴加 0.1 mol·L 1NaOH 溶液, 其 pH 变化分别对应下图中的Ⅰ、Ⅱ。下列说法不正确的是

A.向 NaA 溶液中滴加 HB 可产生 HA
B.a点,溶液中微粒浓度:c(A-) > c(Na+) > c(HA)
C.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)= c(B-)
D.滴加 20 mL NaOH 溶液时,Ⅰ中 H2O 的电离程度大于Ⅱ中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com