
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学课外兴趣小组为了探究影响化学反应速率的因素,做了以下实验。
(1)用三支试管各取5.0 mL、0.01 mol·L-1的酸性KMnO4溶液,再分别滴入0.1 mol·L-1 H2C2O4溶液,实验报告如下。

①实验1、3研究的是_________对反应速率的影响。
②表中V=_________mL。
(2)小组同学在进行(1)中各组实验时,均发现该反应开始时很慢,一段时间后速率会突然加快。对此该小组的同学展开讨论:
①甲同学认为KMnO4与H2C2O4的反应放热,温度升高,速率加快。
②乙同学认为随着反应的进行,因_________,故速率加快。
(3)为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学又分别设计了如图甲、乙所示的实验。回答相关问题:

①装置乙中仪器A的名称为_________。
②定性如图甲可通过观察反应产生气泡的快慢,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是____________________________________。
③定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种短周期元素,它们在周期表中的位置如图所示,下列说法正确的是( )
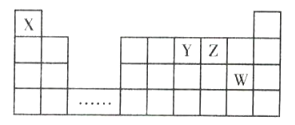
A.四种元素的原子半径由小到大的顺序为r(X)<r(Z)<r(W)<r(Y)
B.X、Y、Z既能形成离子化合物,又能形成共价化合物
C.X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D.H2Z与HW所含的化学键类型不同
查看答案和解析>>
科目: 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
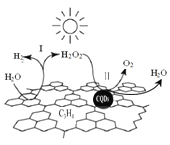
A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目: 来源: 题型:
【题目】祖母绿被称为绿宝石之王,是四大名贵宝石之一,其主要成分为Be3Al2Si6O18,因含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)祖母绿宝石属于晶体,鉴别晶体最可靠的科学方法是_____________。
(2)基态Cr原子的价层电子排布式为_________;基态Si原子电子占据最高能级的电子云轮廓图为_________。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是_______,1 mol Cr(CO)6中含σ键的数目为_________;
(4)BeCl2分子的空间构型是_________,写出该分子的一种等电子体的分子式_________。它的二聚体Be2Cl4结构如图所示Cl-Be![]() Be-Cl,,其中Be原子的杂化方式是_________。
Be-Cl,,其中Be原子的杂化方式是_________。
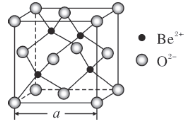
(5)BeO的立方晶胞如图所示,在该晶胞中与一个O2-距离最近且相等的O2-有________个。若该晶体的密度为d g·cm-3,设阿伏加德罗常数的值为NA,则晶胞边长a=________nm。(列出计算表达式)
(6)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用△表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]3+________ △[Fe(H2O)6]2+(填“>”、“=”或“<”),理由是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如下:
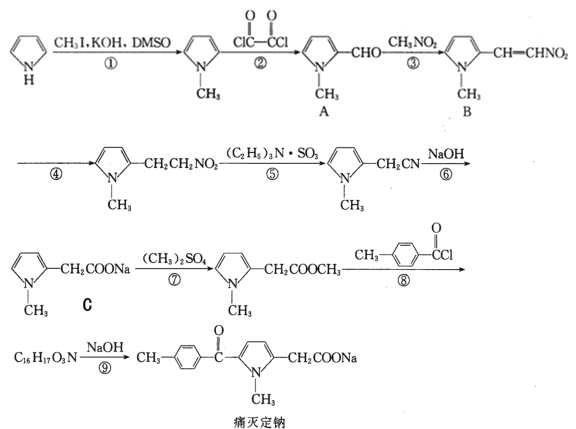
回答下列问题:
(1)化合物 C 中含氧官能团的名称是_____。
(2)化学反应①和④的反应类型分别为_____和_____。
(3)下列关于痛灭定钠的说法正确的是_____。
a.1mol 痛灭定钠与氢气加成最多消耗 7molH2 b.核磁共振氢谱分析能够显示 6 个峰 c.不能够发生还原反应 d.与溴充分加成后官能团种类数不变 e.共直线的碳原子最多有 4 个
(4)反应⑨的化学方程式为_____。
(5)芳香族化合物 X 的相对分子质量比 A 大 14,遇 FeCl3 溶液显紫色的结构共有_____种(不考虑立体异构),核磁共振氢谱分析显示有 5 个峰的 X 的结构简式有_____。
(6) 根据该试题提供的相关信息,写出由化合物![]() 及必要的试剂制备有机化合物
及必要的试剂制备有机化合物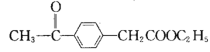 的合成路线图。________________
的合成路线图。________________
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸亚铁可用于制备补血剂。某研究小组制备了 FeCO3,并对 FeCO3 的性质和应用进行了探究。 已知:①FeCO3 是白色固体,难溶于水②Fe2++6SCN-![]() Fe(SCN)64-(无色)
Fe(SCN)64-(无色)
Ⅰ. FeCO3 的制取(夹持装置略)
实验i:
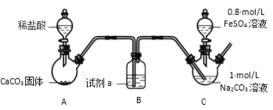
装置 C 中,向 Na2CO3 溶液(pH=11.9)通入一段时间 CO2 至其 pH 为 7,滴加一定量 FeSO4 溶液,产生白色沉淀,过滤、洗涤、干燥,得到 FeCO3 固体。
(1)试剂 a 是_____。
(2)向 Na2CO3 溶液通入 CO2 的目的是_____。
(3)C 装置中制取 FeCO3 的离子方程式为_____。
(4)有同学认为 C 中出现白色沉淀之后应继续通 CO2,你认为是否合理并说明理由________。
Ⅱ.FeCO3 的性质探究
实验ii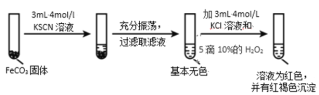
实验iii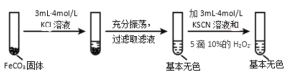
(5)对比实验ⅱ和ⅲ,得出的实验结论是_____。
(6)依据实验ⅱ的现象,写出加入 10%H2O2 溶液的离子方程式_____。
Ⅲ.FeCO3 的应用
(7)FeCO3 溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁([CH3CH(OH)COO]2Fe,相对分子质量 为 234)补血剂。为测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,树德中学化学实验小组准确称 量 1.0g 补血剂,用酸性 KMnO4 溶液滴定该补血剂,消耗 0.1000mol/L 的 KMnO4 溶液 10.00mL,则乳酸亚铁在补血剂中的质量分数为_____,该数值异常的原因是________(不考虑操 作不当以及试剂变质引起的误差)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年10月22日,位于资阳市境内的“安岳气田”天然气产量达到10.33亿立方米,历史性突破10亿立方米大关。“安岳气田”的开发,将惠及川渝地区天然气供给,促进地方经济社会的发展。对天然气的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用。
(1)已知甲烷临氧耦合CO2重整反应有:
反应I:2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4 kJ·mol-1
2CO(g)+4H2(g) △H=-71.4 kJ·mol-1
反应II:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0 kJ·mol-1
2CO(g)+2H2(g) △H=+247.0 kJ·mol-1
已知断裂1 mol化学键所需的能量:
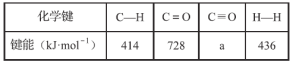
①a=_________。
②写出表示CO燃烧热的热化学方程式:____________________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在温度为753K下进行(1)中反应II(不发生其它反应),CO2的平衡转化率如下表所示:
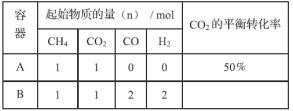
①若容器A中反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(CO2)=_________(用含t的表达式表示)。
②温度为753K时该反应的平衡常数K=_________;容器B中的反应起始时将_________移动(填“正向”、“逆向”或“不”)。
③该反应达到平衡时,其他条件不变,若升高温度,此时v正_________ v逆(填“>”、“=”或“<”)。
④当容器A、B中的反应均达到平衡时,容器中n(CO)满足的关系:2n(CO)A______n(CO)B(填“>”、“=”或“<”)。
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生(1)中反应I,相同时间段内测得CO的体积分数[φ(CO)]与温度(T)的关系如图如示。
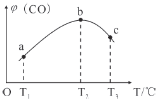
bc段CO的体积分数[φ(CO)]降低的主要原因是____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Al、Ti、Co、Cr、Zn 等元素形成的化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3 时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6 的结构式为_____;(标出配位键)其中 Al 的配位数为_________。
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有_____种。
(4)Co2+的价电子排布式_________。NH3 分子与 Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH_____(填“较大”,“较小”或“相同”),解释原因_____。
(5)已知 CrO5 中铬元素为最高价态,画出其结构式:_____。
(6)阿伏加德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置_____。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的半径为 a pm,晶体的密度为 ρg/cm3,阿伏加德罗常数 NA=_____mol-1(列计算式表达)。
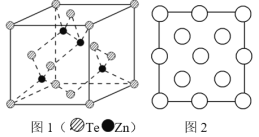
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)是硫酸工业中非常重要的一个反应,因该反应中使用催化剂而被命名为接触法制硫酸。
2SO3(g)是硫酸工业中非常重要的一个反应,因该反应中使用催化剂而被命名为接触法制硫酸。
(1)使用 V2O5 催化该反应时,涉及到催化剂 V2O5 的热化学反应有:
①V2O5 (s)+SO2 (g)![]() V2 O4 (s)+SO3 (g) △H1=+59.6kJ·mol-1
V2 O4 (s)+SO3 (g) △H1=+59.6kJ·mol-1
②2V2O4(s)+O2(g)![]() 2V2O5(s) △H2=-314.4kJ·mol-1
2V2O5(s) △H2=-314.4kJ·mol-1
则2SO2(g)+O2(g)![]() 2SO3(g) △H3=_____,若降低温度,该反应速率会_____(填“增大”或“减小”)
2SO3(g) △H3=_____,若降低温度,该反应速率会_____(填“增大”或“减小”)
(2)向 10 L 密闭容器中加入 V2O4(s)、SO2(g)各 1 mol 及一定量的 O2,改变加入 O2 的量,在常温下反应一段时间后,测得容器中 V2O4、V2O5、SO2 和 SO3 的量随反应前加入 O2 的变化如图甲所示,图中没有 生成 SO3 的可能原因是____________________________________________________。
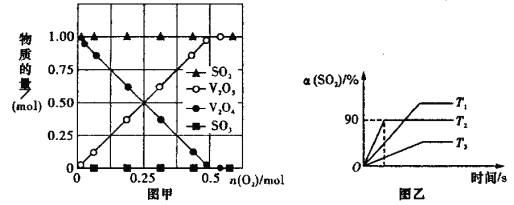
(3)向 10 L 密闭容器中加入 V2O5(s)、SO2(g)各 0.6mol,O2(g)0.3mol,保持恒压的条件下 分别在 T1、T2、T3 三种温度下进行反应,测得容器中 SO2 的转化率如图乙所示。
①T1 _____T2(填“>”或“<”)。
②T2时,2SO2(g)+O2(g)![]() 2SO3(g)的平衡常数K=_____。若向该容器通入高温 He(g)(不参加反应,高于T2),SO3 的产率将______选填“增大”“减小”“不变”“无法确定”),理由是_____。
2SO3(g)的平衡常数K=_____。若向该容器通入高温 He(g)(不参加反应,高于T2),SO3 的产率将______选填“增大”“减小”“不变”“无法确定”),理由是_____。
③结合化学方程式及相关文字,解释反应为什么在 T3 条件下比 T2 条件下的速率慢:__________。
(4)T2 时使用 V2O5 进行反应:2SO2(g)+O2(g)![]() 2SO3(g),在保证 O2(g)的浓度不变的条件下,增大容器的体积,平衡_____(填字母代号)。
2SO3(g),在保证 O2(g)的浓度不变的条件下,增大容器的体积,平衡_____(填字母代号)。
A.向正反应方向移动 B.不移动 C.向逆反应方向移动 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com