
科目: 来源: 题型:
【题目】砂质土壤分析中常用KarlFischer法是测定其中微量水含量,该方法原理是I2和SO2反应定量消耗水(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:________________________。
步骤①:消耗反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:
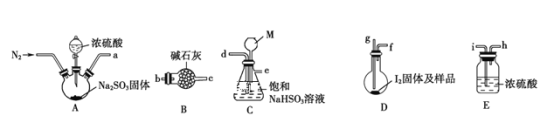
(2)装置连接的顺序为a__________(填接口字母顺序);M仪器的名称为__________,其在实验过程中的作用是__________________________。
(3)操作步骤①:连接装置并检查装置气密性,装入药品,_________________;关闭弹簧夹,打开分液漏斗活塞;反应结束后,关闭分液漏斗活塞,继续通入N2,取下D装置;步骤②:测定剩余的碘时,向反应后的D装置加入蒸馏水,过滤,充分洗涤滤渣,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的碘单质,已知反应如下:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-。
+2I-。
(4)Na2S2O3标准液应装在________(填“酸式”“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是________________________________。
(5)滴定实验重复四次得到数据如下:
实验 | 1 | 2 | 3 | 4 |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00g土壤样品和10.16gI2(已知I2过量),则样品土壤中水的含量为________%(计算结果保留小数点后一位)。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:

已知:①CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
② B- F苯环上均只有两个取代基
回答下列问题:
(1)A的化学名称是___,C中含氧官能团的名称是___
(2)E→F的反应类型是___,G的分子式为___。
(3)D的结构简式为___。
(4)反应B→C的化学方程式为___
(5)芳香族化合物W是G的同分异构体,W能发生水解反应,核磁共振氢谱有4组峰,峰面积之比为9:3:2:2,写出一种符合要求的W的结构简式:___.
(6)4一苄基苯酚(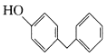 )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
查看答案和解析>>
科目: 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
电离能 | I1 | I2 | I3 | I4 | I5 |
电离能/(kJ·mol-1) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为________________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________。
(3)PO43-的中心原子的杂化方式为________,该离子的空间构型为________,键角为________,其等电子体有________(请写出两种)。
(4)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为________,原因为__________________。
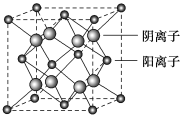
(5)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________ g·cm-3(不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g) ![]() CH2ClCHClCH3(g) H1=-134kJ·mol-1
CH2ClCHClCH3(g) H1=-134kJ·mol-1
II.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g) ![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。p点是否为对应温度下CH2ClCHClCH3的平衡产率,_________填“是”或“否”)判断理由是_______________________。

(5)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]()
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() ____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有X、Y两种第![]() 族元素,下列事实不能说明X的非金属性比Y强的是( )
族元素,下列事实不能说明X的非金属性比Y强的是( )
A.两种元素所形成的酸的酸性:![]()
B.两种元素所形成的气态氢化物的稳定性:![]()
C.两种元素所形成的最高价氧化物的稳定性:![]()
D.两种元素所形成的气态氢化物的还原性:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】1999年1月,俄美科学家联合小组宣布合成了114号元素的一种同位素原子,其中子数为184,有关该元素和同位素原子的叙述中不正确的是( )
A.该原子位于元素周期表第七周期第![]() 族
族
B.该元素为金属,性质与![]() 相似
相似
C.该元素相对原子质量是298
D.该元素主要化合价为![]() 和
和![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.碳原子间都以碳碳单键结合,其余的价键均与氢原子结合即为烷烃分子,这一系列化合物的分子通式为![]()
B.分子式相同,各元素质量分数也相同的物质是同种物质
C.烷烃分子中,相邻的三个碳原子有可能在同一条直线上
D.![]() 、
、![]() 互为同系物
互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】H2C2O4(草酸)为二元弱酸,在水溶液中H2C2O4、HC2O4-和C2O42-物质的量分数与pH关系如图所示,下列说法不正确的是
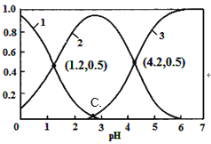
A.根据图中数据计算可得C点溶液pH为2.7
B.向草酸溶液中滴加氢氧化钠溶液至pH为4.2时c(Na+)+c(H+)=3c(C2 O42-)+c(OH-)
C.0.1 mol·L-1NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HC2O4-)> c(C2 O42-) >c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】丙胺卡因(H)是一种局部麻醉药物,实验室制备H的一种合成路线如下:
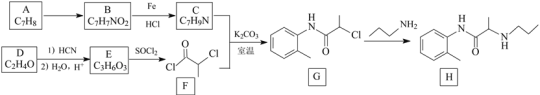
已知:![]()
![]()
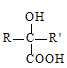 (R和R'为烃基或H)
(R和R'为烃基或H)
回答下列问题:
(1)B的化学名称是___________,H的分子式是____________。
(2)C中所含官能团的名称为_______________,由G生成H的反应类型是___________。
(3)C与F反应生成G的化学方程式为___________。反应中使用K2CO3的作用是_______。
(4)化合物X是E的同分异构体,X能与NaOH溶液反应,其核磁共振氢谱只有1组峰。X的结构简式为________。
(5)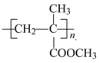 (聚甲基丙烯酸甲酯)是有机玻璃的主要成分,写出以丙酮(CH3COCH3)和甲醇为原料制备聚甲基丙烯酸甲酯单体的合成路线___________。(无机试剂任选)
(聚甲基丙烯酸甲酯)是有机玻璃的主要成分,写出以丙酮(CH3COCH3)和甲醇为原料制备聚甲基丙烯酸甲酯单体的合成路线___________。(无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过__________方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为______。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
![]()
该配离子中含有的化学键类型有_______________(填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含_____________mol σ键。
(6)某种磁性氮化铁的结构如图所示

N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为______g/cm3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com