
科目: 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的 稀溶液混合,则放出的热量大于57.3 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.将溴丙烷与氢氧化钾水溶液混合加热,再滴加硝酸银溶液,观察到有沉淀生成,可证明溴丙烷与氢氧化钾发生了反应
B.1mol·L-1CuSO4溶液2mL和0.5mol·L-1NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸可观察到砖红色沉淀
C.向试管中加入3~4![]() 无水乙醇,将试管浸入50℃左右热水浴中。将铜丝烧热,迅速插入乙醇中,反复多次,可以闻到刺激性气味
无水乙醇,将试管浸入50℃左右热水浴中。将铜丝烧热,迅速插入乙醇中,反复多次,可以闻到刺激性气味
D.热的苯酚溶液自然冷却变浑浊,是因为温度降低析出了苯酚晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.2000molL-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3mL酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数请回答:
(1)以上步骤有错误的是___(填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___(从图中选填“甲”或“乙”)中。
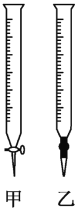
(3)下列操作会引起实验结果偏大的是___(填编号)。
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视___。判断到达滴定终点的现象是:锥形瓶中溶液___。
(5)以下是实验数据记录表:
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
通过计算可得,该盐酸浓度为___ molL-1(计算结果保留4位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇的结构简式为![]() 。请回答下列问题:
。请回答下列问题:
①基态镍原子的价电子排布式为________。
②![]() 键,烯丙醇分子中碳原子的杂化类型是__________。
键,烯丙醇分子中碳原子的杂化类型是__________。
(2)乙炔是有机合成的一种重要原料。实验室可用![]() 与水反应得到乙炔。
与水反应得到乙炔。
①将乙炔通入![]() 溶液中生成
溶液中生成![]() 红棕色沉淀。基态
红棕色沉淀。基态![]() 的核外电子排布式为____。
的核外电子排布式为____。
②乙炔与![]() 反应可得丙烯腈(
反应可得丙烯腈(![]() ),丙烯腈分子中碳原子的的杂化轨道类型是_______,分子中含有
),丙烯腈分子中碳原子的的杂化轨道类型是_______,分子中含有![]() 键的数目为___________。
键的数目为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧(![]() )在
)在![]() 催化下能将烟气中的
催化下能将烟气中的![]() 、
、![]() 分别氧化为
分别氧化为![]() 和
和![]() ,
,![]() ,也可在其他条件下被还原为
,也可在其他条件下被还原为![]() 。
。
(1)![]() 中心原子轨道的杂化类型为__________;
中心原子轨道的杂化类型为__________;![]() 的空间构型为__________(用文字描述)。
的空间构型为__________(用文字描述)。
(2)与![]() 分子互为等电子体的一种阴离子为__________(填化学式)。
分子互为等电子体的一种阴离子为__________(填化学式)。
(3)![]() 分子中
分子中![]() 键与
键与![]() 键的数目比
键的数目比![]() __________。
__________。
(4)![]() 与
与![]() 反应生成的
反应生成的![]() 中,
中,![]() 以
以![]() 原子与
原子与![]() 形成配位键。请在
形成配位键。请在![]() 结构示意图的相应位置补填缺少的配体_________。
结构示意图的相应位置补填缺少的配体_________。
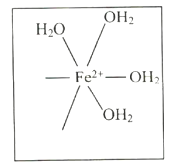
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
|
|
|
|
|
| |
熔点/℃ | -85.5 | 115.2 | >600 | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | (分解) | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)根据价层电子对互斥理论,![]() 、
、![]() 、
、![]() 的气态分子中,中心原子价层电子对数不同于其他分子的是__________。
的气态分子中,中心原子价层电子对数不同于其他分子的是__________。
(2)气态三氧化硫以单分子形式存在,其分子的立体构型为__________形,其中共价键的类型有__________种;固体三氧化硫中存在如图所示的三聚分子,该分子中![]() 原子的杂化轨道类型为__________。
原子的杂化轨道类型为__________。

查看答案和解析>>
科目: 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=___,ΔH___0(填“<”“>”或“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003molL-1s-1,则6s时c(A)=___molL-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为___,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为___。
(3)一定温度下,能判断该反应达化学平衡状态的是___。
①单位时间内生成nmolA,同时消耗nmolC
②A的转化率不变
③容器内压强不再变化
④混合气体的密度不再变化
⑤混合气体的平均相对分子质量不再变化
(4)1200℃时,C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为___。
A(g)+B(g)的平衡常数的值为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)![]() 中含有离子键,
中含有离子键,![]() 不溶于有机溶剂而
不溶于有机溶剂而![]() 、
、![]() 、
、![]() 能够溶于乙醇、乙醚等有机溶剂,原因是__________。
能够溶于乙醇、乙醚等有机溶剂,原因是__________。
(2)《中华本草》等中医典籍中,记载了炉甘石(![]() )入药,可用于治疗皮肤炎症或表面创伤。
)入药,可用于治疗皮肤炎症或表面创伤。![]() 中,阴离子空间构型为__________,
中,阴离子空间构型为__________,![]() 原子的杂化形式为__________。
原子的杂化形式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com