
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。某高能锂离子电池的反应方程式为Li1-xCoO2+LixC6![]() LiCoO2+C6(x<l)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸,工作原理如图所示(注明:酸化电解后的苯甲酸盐可以析出苯甲酸)。
LiCoO2+C6(x<l)。以该锂离子电池为电源、苯乙酮为原料制备苯甲酸,工作原理如图所示(注明:酸化电解后的苯甲酸盐可以析出苯甲酸)。
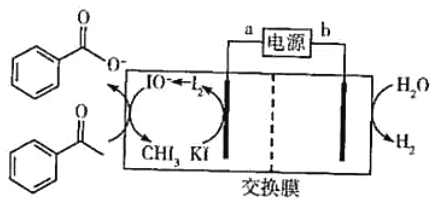
下列说法正确的是( )
A.锂离子电池的a极为负极
B.放电时,正极反应式为xLi++xe-+Li1-xCoO2=LiCoO2
C.交换膜为质子交换膜
D.每产生4.48LH2(标准状况),生成0.4molIO-
查看答案和解析>>
科目: 来源: 题型:
【题目】PET(![]() ,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
A.PET塑料是一种可降解高分子材料
B.滴定终点时,溶液变为浅红色
C.合成PET的一种单体是乙醇的同系物
D.PET的平均聚合度![]() (忽略端基的摩尔质量)
(忽略端基的摩尔质量)
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
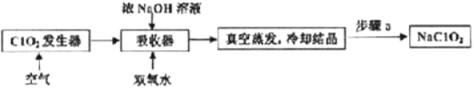
下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.电解精炼铜时,若阳极质量减少64 g,则转移到阴极的电子数不一定等于2NA
B.18 g氨基(-ND2)中含有的电子数为10NA
C.用惰性电极电解100 mL 0.1 mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0. 04NA
D.工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】某新型药物G合成路线如图所示:
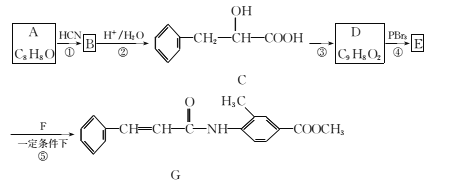
已知:Ⅰ.RCHO![]()
![]() (R为烃基);
(R为烃基);
Ⅱ.RCOOH![]()
![]() ;
;
Ⅲ. ![]() +RNH2
+RNH2![]()
![]()
请回答下列问题:
(1)A的名称为 ___,合成路线图中反应③所加的试剂和反应条件分别是______。
(2)下列有关说法正确的是 __(填字母代号)。
A. 反应①的反应类型为取代反应
B. C可以发生的反应类型有取代、加成、消去、加聚
C. D中所有碳原子可能在同一平面上
D. 一定条件下1 mol G可以和2 mol NaOH或者9 mol H2反应
(3)F的结构简式为____。
(4)C在一定条件下可以发生聚合反应生成高分子化合物,写出该反应的化学方程式 ______。
(5)D有多种同分异构体,同时满足下列条件的同分异构体有 ___种。
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)参照G的上述合成路线,设计一条由乙醛和H2NCH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线______。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空。
(1)![]() 的核外电子排布式:________________________ 。
的核外电子排布式:________________________ 。
(2)![]() 的价电子排布式:________________________ 。
的价电子排布式:________________________ 。
(3)![]() 的电子式:________________________ 。
的电子式:________________________ 。
(4)![]() 的价电子轨道表示式: ________________________ 。
的价电子轨道表示式: ________________________ 。
(5)![]() 的原子结构示意图: ________________________ 。
的原子结构示意图: ________________________ 。
(6)第四周期中最外层只有1个电子的所有基态原子的简化电子排布式:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国矿石种类很多,如黄铜矿、煤、锰矿、锑锌矿等,请回答下列问题:
(l)黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),基态Cu2+的外围电子排布图为 ______,Fe2+含有 ___个未成对电子。
(2)Mn的第三电离能比Fe的第三电离能大的原因为 ___。
(3)煤化工可得氨气、苯、甲苯等产品,氨的空间构型为 ___,甲苯分子上甲基的碳原子的杂化方式为____;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷的结构式为____(配位键用“→”表示),与氨硼烷互为等电子体的有机小分子为_____写名称)。
(4)碲化锌的晶胞结构如图1所示。
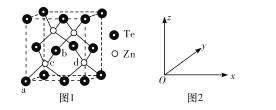
①碲化锌的化学式为____。
②图2可表示晶胞内部各原子的相对位置,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),则d的原子坐标参数为____
),则d的原子坐标参数为____
③若两个距离最近的Te原子间距离为apm,阿伏加德罗常数值为NA,则晶体密度为____g/cm3(用含有NA、a的代数式表示,不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3、NOx、SO2处理不当易造成环境污染,如果对这些气体加以利用就可以变废为宝,既减少了对环境的污染,又解决了部分能源危机问题。
(l)硝酸厂常用催化还原方法处理尾气。CH4在催化条件下可以将NO2还原为N2。已知:
![]() ①
①
![]() ②
②
则反应![]() (1)△H=_______
(1)△H=_______
(2)工业上利用氨气生产氢氰酸(HCN)的反应为:
①在一定温度条件下,向2L恒容密闭容器中加入2 mol CH4和2 mol NH3,平衡时NH3体积分数为30%,所用时间为10 min,则该时间段内用CH4的浓度变化表示的反应速率为______ mol·L-l·min-1,该温度下平衡常数K= ___。若保持温度不变,再向容器中加入CH4和H2各1 mol,则此时v正 ___(填“>”“=”或“<”)v逆 。
②其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图1所示。X代表 ___(填字母代号)。
A 温度 B 压强 C 原料中CH4与NH3的体积比
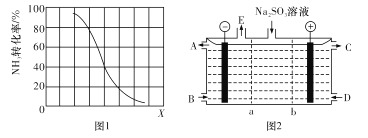
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图2所示,电极材料为石墨。A--E分别代表生产中的原料或产品,b表示____(填“阴”或“阳”)离子交换膜。阳极的电极反应式为_______
查看答案和解析>>
科目: 来源: 题型:
【题目】铅的单质、氧化物、盐在现代T业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、还有组成类似Fe3O4的PbO2。请将Pb3O4改写成简单氧化物的形式: ___。
Ⅱ.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,实现铅的再生利用。其工作流程如下:
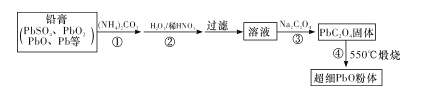
(2)步骤①的目的是“脱硫”,即将PbSO4转化为PbCO3,反应的离子方程式为____。 “脱硫过程”可在如图所示的装置中进行。实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h。
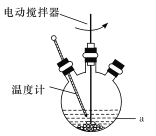
①仪器a的名称是____;转化温度为35℃,采用的合适加热方式是____。
②步骤②中H2O2的作用是____(用化学方程式表示)。
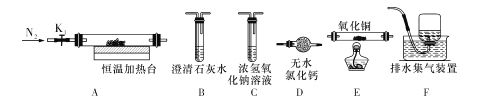
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A ___(填装置字母代号),证明产物中有CO气体的实验现象是____。
(4)测定草酸铅样品纯度:称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA( Na2H2Y)标准溶液滴定其中的Pb2+(反应方程式为____,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14. 52 mL。
①若滴定管未用EDTA标准液润洗,测定结果将 ___(填“偏高”“偏低”或“不变”)。
②草酸铅的纯度为 ___(保留四位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是

A.水的电离程度:M>PB.图中P点至Q点对应溶液中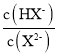 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com