
科目: 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是 ( )
A. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
B. 工业生产玻璃、水泥,均需要用石灰石为原料
C. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
D. 纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属Co、Ni性质相似,在电子工业以及金属材料上应用十分广泛.现以含钴、镍、铝的废渣(含主要成分为CoO、Co2O3、Ni、少量杂质Al2O3)提取钴、镍的工艺如下:
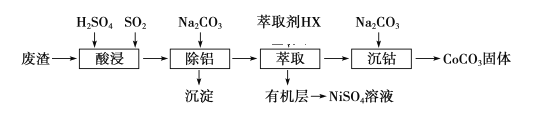
(1)酸浸时SO2的作用是___________________________________。
(2)除铝时加入碳酸钠产生沉淀的离子反应_________________________________。
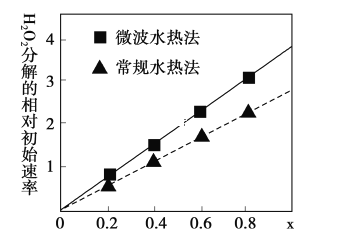
(3)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价).如图是用两种不同方法制得的CoxNi(1-x)Fe2O4 在10℃时催化分解6%的H2O2 溶液的相对初始速率随x 变化曲线.
①H2O2 的电子式_________________________________。
②由图中信息可知:_________________________________法制取的催化剂活性更高。
③Co2+ 、Ni2+ 两种离子中催化效果更好的是_________________________________。
(4)已知煅烧CoCO3时,温度不同,产物不同.在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列装置制备并检验Cl2的性质,下列有关说法正确的是( )

A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B.Ⅱ图中:充分光照后,量筒中剩余气体约为10 mL(条件相同)
C.Ⅲ图中:生成蓝色的烟,若在集气瓶中加入少量水,所得溶液呈绿色
D.Ⅳ图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化钠(NaCN)是一种基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是______。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
某化学小组利用上述原理在实验室制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。

(2)装置中盛放双氧水的仪器名称是______。
(3)装置a中反应产生的气体需要持续通入装置c的原因是______。
(4)上述装置中还需补充的实验仪器或装置有______(填字母)。
A.温度计 B.洗气瓶 C.水浴加热装置 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L。
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.0×10-3mol/L 的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL。
(5)滴定终点的现象是______。
(6)处理后的废水是否达到排放标准?______(填“是”或“否”)。
Ⅲ.(7)常温下,含硫微粒主要存在形式,受pH影响。利用电化学原理,用惰性电极电解饱和NaHSO4溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为HSO4-,则阳极反应方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】制备(NH4)2Fe(SO4)2·6H2O 的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.通入过量Cl2:Fe2+、H+、![]() 、Cl、
、Cl、![]()
B.加入少量NaClO溶液:![]() 、Fe2+、H+、
、Fe2+、H+、![]() 、ClO
、ClO
C.加入过量NaOH 溶液:Na+、Fe2+、![]() 、
、![]() 、OH
、OH
D.加入过量NaClO和NaOH的混合溶液:Na+、![]() 、Cl、ClO、OH
、Cl、ClO、OH
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫铁矿(主要成分为![]() )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体(![]() )的工艺流程如下所示:
)的工艺流程如下所示:

下列说法不正确的是
A. “酸溶”过程中使用的酸也可以是硝酸
B. 为防止污染,“焙烧”过程中产生的![]() 应回收利用
应回收利用
C. 通入氯气的目的是氧化![]()
D. 用![]() 制取无水
制取无水![]() 时,需要在氯化氢气流中加热
时,需要在氯化氢气流中加热
查看答案和解析>>
科目: 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是 ;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因 。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);G的基态原子电子排布式是
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是 ;该化合物中Y的杂化轨道类型是 。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是
(5)可用YX4还原ZOx以消除其污染。已知:
YX4(g) +4ZO2(g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4(g)+4ZO(g)=2Z2(g)十YO2(g) +2X2O(g) △H =" -1160" kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式___ _。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝苯地平H是一种治疗高血压的药物;其一种合成路线如下:
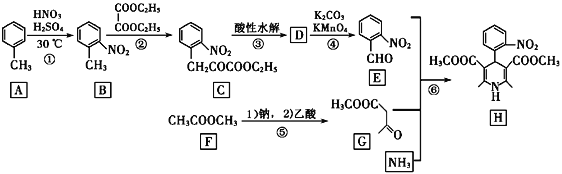
已知:酯分子中的a-碳原子上的氢比较活泼,使酯与酯之间能发生缩合反应。
![]()
回答下列问题:
(1)B的化学名称为________.
(2)②的反应类型是________.
(3)D的结构简式为________.
(4)H的分子式为________.
(5)反应①的化学方程式为________.
(6)已知M与G互为同分异构体,M在一定条体下能发生银镜反应,核磁共振氢谱显示有4组峰,峰面积之比为1:1:2:4,写出M的一种可能的结构简式________.
(7)拉西地平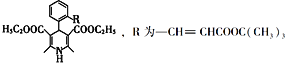 也是一种治疗高血压药物,设以乙醇和
也是一种治疗高血压药物,设以乙醇和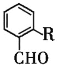 为原料制备拉西地平的合成路线(无机试剂任选)。________________________
为原料制备拉西地平的合成路线(无机试剂任选)。________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com