
科目: 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)。
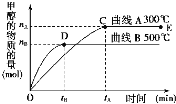
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=__________,升高温度,K值__________(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是__________(填字母序号)。
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的有
①3lg白磷中含有1.5NA个P-P键
②1L0.1mol·L-1的Na2CO3溶液中所含阴离子的总数目为0.1NA
③标准状况下,22.4LHF 中含有NA个分子
④电解精炼铜时,若转移NA个电子,则阳极溶解32g铜
⑤将2.24L(标准状况)Cl2溶于水,转移的电子数为0.1NA
⑥常温下,含有0.2molH2SO4的浓硫酸与足量铜反应,生成SO2分子的数目小于0.1NA
⑦142gNa2SO4 和Na2HPO4的固体混合物中所含阴、阳离子的总数目为3NA
⑧NA个Fe(OH)3胶体粒子的质量为107g
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目: 来源: 题型:
【题目】有关有机物的说法正确的是
A.1mol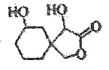 最多能消耗3 mol NaOH,不能与H2加成
最多能消耗3 mol NaOH,不能与H2加成
B.辛酸的同分异构体(CH3)3CCH (CH3) CH2COOH的名称为2,2,3-三甲基戊酸
C.1,3,5-三甲苯的二氯代物有5种
D.异丙苯和对甲乙苯互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银精矿(其化学成分有:Ag、Zn、Cu、Pb、S及SiO2等)中提取银、铜和铅,工艺流程如图所示。

(1)步骤①当盐酸的浓度和KClO3的量一定时,写出两点可提高“浸取”速率的措施______;从Cu和Pb混合物中提取Cu的试剂为______(填名称)。
(2)步骤③反应的化学方程式为______。
(3)步骤④分离出的滤渣中主要含有两种杂质,为了回收滤渣中的非金属单质,某实验小组向滤渣中加入试剂______(填化学式),充分溶解后过滤,然后将滤液进行______(填操作名称),得到该固体非金属单质。
(4)步骤⑤反应中氧化剂和还原剂的物质的量之比为______。
(5)排放后的废水中含有NO3-,任意排放会造成水体污染,科技人员在碱性条件下用Al粉将NO3-还原成无污染气体排放,该方法的缺点是处理后的水中生成了AlO2-,依然对人类健康有害。该反应的离子方程式为:______。25℃时,欲将上述处理过的水中的c(AlO2-)降到1.0×10-7mol/L,此时水中c(Al3+)=______molL-1.(已知,25℃,Ksp(Al(OH)3]=1.3×10-33,Al(OH)3(s)H++AlO2-+H2O,Ka=1.0×10-13)
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组探究SO2与Cu(OH)2悬浊液的反应。
(1)实验一:用如图装置(夹持装置已略,气密性已检验)制备SO2,将SO2通入Cu(OH)2悬浊液的反应中。B中出现少量红色沉淀;稍后,B中所得溶液呈绿色,与CuSO4溶液、CuCl2溶液的颜色有明显不同。
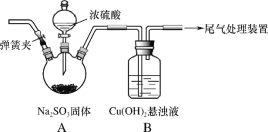
①排除装置中的空气,避免空气对反应干扰的操作是_____,关闭弹簧夹。
②打开分液漏斗旋塞,A中发生反应的方程式是_____。
(2)实验二:为确定红色固体成分,进行以下实验:
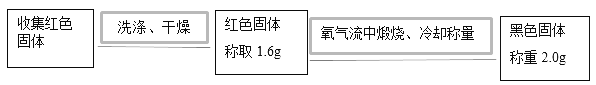
①在氧气流中煅烧红色固体的目的是_____。
②根据上述实验可得结论:该红色固体为_____。
(3)实验三:为探究B中溶液呈绿色而不是蓝色的原因,实验如下:
i.向4mL1mol/L的CuSO4溶液中通入过量SO2,未见溶液颜色发生变化。
ii.取少量B中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝色溶液。再加入BaCl2溶液,出现白色沉淀。
查阅资料:SO2在酸性条件下还原性较差。
①实验i的目的_____。
②根据上述实验可得结论:溶液显绿色的原因是溶液中含有较多Cu(HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol/L的CuSO4溶液中加入_____溶液,得到绿色溶液。
(4)综上实验可以得出:出现红色沉淀的原因是:_____;(用离子方程式表示)溶液呈现绿色的原因是:_____。(用化学方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)由CO2转化为羧酸是CO2资源化利用的重要方法。
I.在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
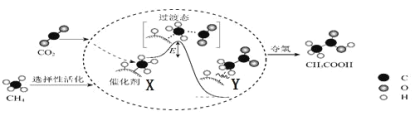
①在合成CH3COOH的反应历程中,下列有关说法正确的是_____。(填字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为_____。
II.电解法转化CO2制HCOOH的原理如图。

①写出阴极CO2还原为HCOO-的电极反应式:_____。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_____。
(2)由CO2合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2和H2可发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①有利于提高合成CH3OH反应中CO2的平衡转化率的措施有_____。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比![]()
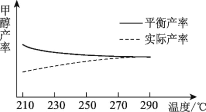
②研究温度对于甲醇产率的影响。在210℃~290℃保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如图所示。ΔH____0(填“>”或“<”),其依据是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。
(1)写出实验室制取氨气的化学方程式_____。
(2)工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
过程中能量变化如图所示。
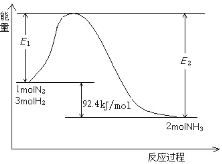
①该反应是_____反应。(填“放热”或“吸热”)
②在反应体系中加入催化剂,E2会_____。(填“增大”或“减小”或“不变”)
③若要增大NH3产率,可采取的措施有_____。(填字母)
a.升高温度 b.增大压强 c.不断分离出NH3
(3)利用如图所示装置探究NH3能否被NO2氧化。
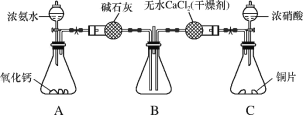
①C装置中制取NO2反应的离子方程式是_____。
②某同学认为NH3能被NO2氧化,且全部生成无毒物质,预期观察到B装置中红棕色消失。下表为不同时间下观察到的现象。
时间 | 1分钟 | 2分钟 | 3分钟 |
现象 | 红棕色未消失 | 红棕色未消失 | 红棕色未消失 |
请分析没有达到预期现象可能的原因(任写两条)_____、_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是( )
① | ② | ③ |
|
|
|
A.由①中的红棕色气体,可推知反应还有氧气产生
B.红棕色气体表明②中木炭与浓硝酸发生了反应
C.由③可说明浓硝酸具有挥发性和强氧化性
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com