
科目: 来源: 题型:
【题目】(1)钛镁合金是制造高性能飞机的重要材料。金属钛、镁均采用六方最密堆积,下列说法正确的是_____(填序号)。
A.钛镁合金用于制造高性能飞机主要是由于它们的价格昂贵,制造出的飞机能卖好价钱
B.钛、镁金属晶体中,其配位数均为12
C.金属钛的熔点(1668℃)很高,与金属键无关
(2)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电学性能。下列说法正确的是______(填序号)。
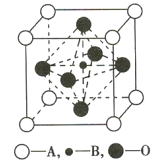
A.金属Ca、Sr、Ba采用体心立方密堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式可表示为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子
(3)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有![]() 三种同素异形体,其晶胞结构如图所示。
三种同素异形体,其晶胞结构如图所示。
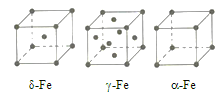
①![]() 晶胞中含有的铁原子数为___________。
晶胞中含有的铁原子数为___________。
②![]() 、
、![]() 两种晶体中铁原子的配位数之比为___________。
两种晶体中铁原子的配位数之比为___________。
③若![]() 晶胞的边长为a cm,
晶胞的边长为a cm, ![]() 晶胞的边长为b cm,则两种晶体的密度之比为___________。
晶胞的边长为b cm,则两种晶体的密度之比为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了________;(填“离子键”“共价键”或“分子间作用力”,下同);二氧化硅熔化,粒子间克服了______;碘升华,粒子间克服了______。三种晶体的熔点由高到低的顺序是______。
(2)下列六种晶体:①CO2、②NaCl、③Na、④Si、⑤CS2、⑥金刚石,它们的熔点由低到高的顺序为_______(用序号表示)。
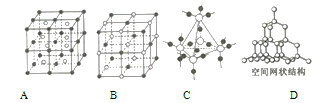
(3)A、B、C、D为四种不同类型的晶体,性质如下:A固态时能导电,能溶于盐酸;B能溶于CS2,不溶于水;C固态时不导电,液态时能导电,可溶于水;D固态、液态时均不导电,熔点为3500℃。
试推断它们的晶体类型:A.____________; B.____________; C.____________; D.____________。
(4)A~D是化学教材中常见的几种晶体结构模型,请填写相应物质的名称:A.____________; B.____________; C.____________; D.____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某无机化合物的二聚分子结构示意图,该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层都达到8个电子的稳定结构。下列说法不正确的是( )
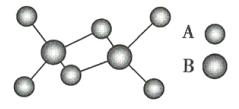
A.该物质的化学式是Al2Cl6B.该物质是离子化合物,在熔融状态下能导电
C.该物质在固态时所形成的晶体是分子晶体D.该物质中不存在离子键,也不含有非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是
A.  在NaCl晶体中,距Na+最近的Cl-形成正八面体
在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.  在CaF2晶体中,每个晶胞平均占有4个Ca2+
在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.  在金刚石晶体中,碳原子与碳碳键数目比为1∶2
在金刚石晶体中,碳原子与碳碳键数目比为1∶2
D.  由E原子和F原子构成的气态团簇分子的分子式为EF或FE
由E原子和F原子构成的气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成。其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子。下列说法错误的是( )
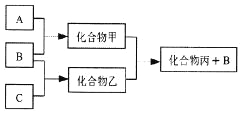
A. Z元素位于第二周期第VIA族
B. 可用排水法收集化合物乙
C. 元素X、Y、Z的原子半径大小关系为X<Z<Y
D. 化合物甲溶于化合物丙中,存在的微粒有5种
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为超氧化钾(KO2)晶体的一个晶胞,则下列有关说法正确的是( )
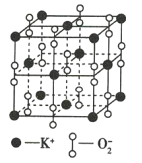
A.KO2中只存在离子键
B.每个晶胞中含有1个K+和1个O2-
C.晶体中与每个K+距离最近且相等的O2-有6个
D.晶体中所有原子之间都以离子键结合
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关晶体的叙述不正确的是( )
A.氯化钠和氯化铯晶体中,阴离子的配位数均为6
B.金刚石为空间网状结构,由碳原子以sp3杂化轨道形成共价键
C.金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目: 来源: 题型:
【题目】现有前四周期的5种元素的部分信息如下表所示:
元素代号 | 元素部分信息 |
X | X的阴离子核外电子云均呈球形 |
Y | 原子的最高能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素所形成的最简单气态氢化物中最大 |
Z | 基态原子核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和 |
R | 元素原子的最外层电子排布式为nsn-1npn-1 |
T | 一种核素的质量数为65,中子数为36 |
根据上述元素信息,回答下列问题。
(1)基态T2+的电子排布式为__。
(2)Y、Z、R的电负性由大到小的顺序为__(用元素符号表示)。
(3)YX4+的空间构型为__,离子中![]() 原子的杂化轨道类型为___,YX4+的电子式为__。
原子的杂化轨道类型为___,YX4+的电子式为__。
(4)YX3的一种等电子体分子是__,YX3的键角大于X2Z的键角的主要原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;![]() 在同周期元素中原子半径最小。
在同周期元素中原子半径最小。
(1)B形成的双原子分子中,共价键的类型有__,化合物A2B中B原子采取__杂化。
(2)A2B和A2D的沸点较高者是__(填化学式),其原因是_。
(3)E原子的电子排布式为__。
(4)写出均由A、B、C、D四种元素组成的两物质的浓溶液发生反应的离子方程式:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,并利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。

其中装置正确且能达到实验目的的组合是( )
A.①②③④B.①②③
C.②④D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com