
科目: 来源: 题型:
 (R、R'代表烃基或氢原子).
(R、R'代表烃基或氢原子).
| △ |
| △ |
 和
和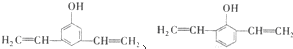 中任意2种
中任意2种 和
和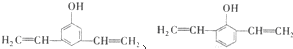 中任意2种
中任意2种查看答案和解析>>
科目: 来源: 题型:
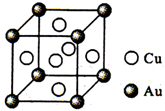 催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.
催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.查看答案和解析>>
科目: 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
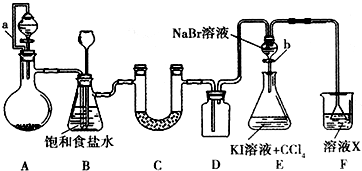 某同学设计如图所示的实验方案,请回答下列问题.
某同学设计如图所示的实验方案,请回答下列问题.查看答案和解析>>
科目: 来源: 题型:阅读理解
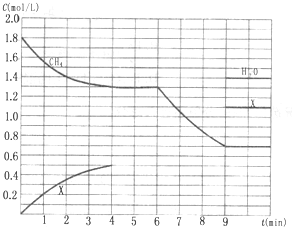 向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com