
科目: 来源: 题型:
 (1)若某药品质量约为32g,用托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下.
(1)若某药品质量约为32g,用托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下.| 50g | 20g | 20g | 10g | 5g |
↓↑ ↓↑ |
↓ ↓ |
↓↑ ↓↑ |
↓ ↓ |
↓↑ ↓↑ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝 码过程) |
↓↑ ↓↑ |
↓ ↓ |
↓↑ ↓↑ |
↓ ↓ |
↓↑ ↓↑ |

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
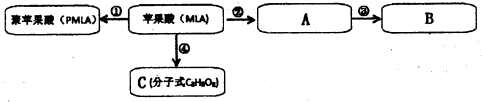
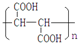
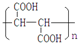


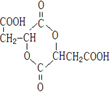



查看答案和解析>>
科目: 来源: 题型:阅读理解
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.| A-B | A=B | A≡B | ||
| CO | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 键能差值(kJ?mol-1) | 441.2 273 | |||
| N2 | 键能(kJ?mol-1) | 154.8 | 418.3 | 941.7 |
| 键能差值(kJ?mol-1) | 263.6 523.3 | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com