
科目: 来源: 题型:
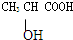 已知乳酸的结构简式如图,试类比乙醇中-OH和乙酸中-COOH的性质,回答下列问题:
已知乳酸的结构简式如图,试类比乙醇中-OH和乙酸中-COOH的性质,回答下列问题: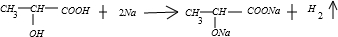
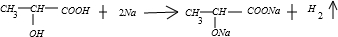
 +Na2CO3→
+Na2CO3→ +H2O+CO2↑
+H2O+CO2↑ +Na2CO3→
+Na2CO3→ +H2O+CO2↑
+H2O+CO2↑查看答案和解析>>
科目: 来源: 题型:阅读理解
 2C(g);△H<0达到平衡.现只改变下列一个条件时,试依据勒夏特列原理,判断平衡移动的方向.(填向左移动、向右移动、不移动)
2C(g);△H<0达到平衡.现只改变下列一个条件时,试依据勒夏特列原理,判断平衡移动的方向.(填向左移动、向右移动、不移动)查看答案和解析>>
科目: 来源: 题型:
| 电离能/kJ?mol-1 | |||||||
| X | 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| Y | 738 | 1451 | 7733 | 10540 | 13630 | 17995 | 21703 |
| Z | 496 | 4562 | 6912 | 9943 | 13353 | 16610 | 20114 |
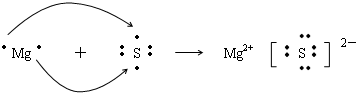

查看答案和解析>>
科目: 来源: 题型:
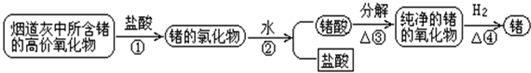
| ||
| ||
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
 某中学化学兴趣小组对乙醇的分子结构进行探究,
某中学化学兴趣小组对乙醇的分子结构进行探究,查看答案和解析>>
科目: 来源: 题型:

| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com