
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验 编号 |
实验步骤 | 实验现象 |
| ① | 用适量的蒸馏水溶解食盐,并将所得溶液分成2份 | |
| ② | 向第一份溶液中加入KSCN溶液,再加入氯水 | 溶液加入KSCN后无明显变化,加入氯水后变红 |
| ③ | 向第二份溶液中加入稀盐酸酸化,再加入足量KI固体,最后加入淀粉溶液 | 溶液变蓝 |
| 实验编号 | 1 | 2 | 3 |
| Na2S2O3溶液的体积/mL | 14.98 | 15.00 | 15.02 |
查看答案和解析>>
科目: 来源: 题型:



| ||


| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
科目: 来源: 题型:
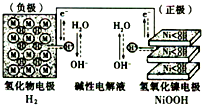 (2013?洛阳一模)“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应.其供电原理是:白天太阳能帆板发电,将一部分电量直接供给天宫一号,另一部分电量储存在镍氢电池里,供黑夜时使用.如图为镍氢电池构造示意图(氢化物电极为储氢金属,可看做H2直接参加反应).下列说法正确的是( )
(2013?洛阳一模)“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应.其供电原理是:白天太阳能帆板发电,将一部分电量直接供给天宫一号,另一部分电量储存在镍氢电池里,供黑夜时使用.如图为镍氢电池构造示意图(氢化物电极为储氢金属,可看做H2直接参加反应).下列说法正确的是( )查看答案和解析>>
科目: 来源: 题型:阅读理解
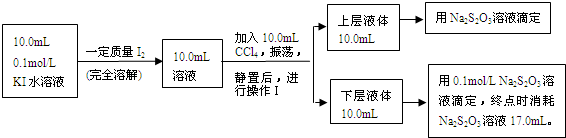
| c[I2(CCl4)] |
| c[I2(H2O)] |
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com