
科目: 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
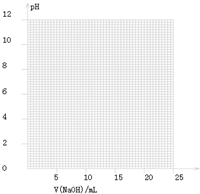
| 指示剂 | 变色的范围(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑ 2NaOH+Cl2↑+H2↑该反应中氧化剂是______,还原剂是______.
2NaOH+Cl2↑+H2↑该反应中氧化剂是______,还原剂是______.查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
科目: 来源: 题型:解答题
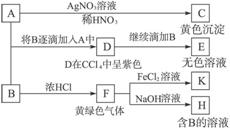
查看答案和解析>>
科目: 来源: 题型:解答题
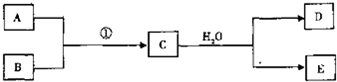
查看答案和解析>>
科目: 来源: 题型:解答题
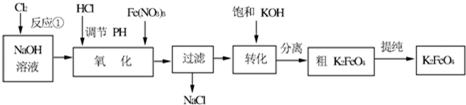
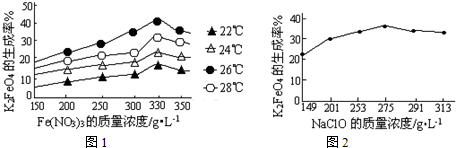
查看答案和解析>>
科目: 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com