
非金属元素
考点聚焦
1.理解非金属的概念。
2.了解元素原子核外电子排布的周期性与元素性质递变关系。重点掌握典型非金属( 卤族元素)在周期表中的位置及与其性质的关系。了解其他常见非金属元素(如:H、O、S 、N、P、C、Si)的单质及其化合物。
知识梳理
一、非金属元素在周期表中的位置和原子结构特点:
1.位置:在已知的元素中,非金属共22种(包括6种稀有气体元素),除氢元素位于周期表的ⅠA族外,其余都集中在元素周期表阶梯线(硼、硅、砷、碲、砹斜线)的右上方。
2。原子结构特点及化合价:
Ⅰ.最外层电子均大于、等于3(除H以外),与其主族序数相同。
Ⅱ.最高正价分别为:+4 +5 +6 +7(与族序数相等)
对应最低负价:-
Ⅲ.非金属元素一般都有变价:除呈现上述最高价及最低价以外,有的非金属还呈现其它价态。如:
S:+4价;N:+1 +2 +3 +4价; Cl:+1 +3 +5价。
3.非金属单质的聚集状态和同素异形体:
①典型的非金属单质在固态时为分子晶体,如:F2、Cl2、Br2、I2、O2、S、N2、P4、H2,这些晶体表现为硬度不大,熔点不高,易挥发、不导电,它们在常温下聚集态为气态(“气”字头)液态(“氵”旁)或固态(“石”字旁)
②碳(金刚石)、硅、硼为原子晶体,硬度很大,熔沸点很高。由于原子晶体中没有离子和自由电子,所以固态和熔融态都不导电。但某些原子晶体,如单晶硅可以作为半导体材料。
③非金属元素常出现同素异形现象。如:金刚石与石墨;白磷与红磷;O2与O3;S2、S4、S8等互为同分异构体。
二、元素非金属性的强弱规律
1.常见非金属元素的非金属性由强到弱的顺序: F、O、Cl、N、Br、I、S、P、C、Si 、H
2.元素的非金属性与非金属单质活泼性是并不完全一致的:如元素的非金属性O>Cl, N>Br;而单质的活泼性:O2 <Cl2,N2<Br2。但由于某些非金属单质是双原子分子,原子间以强烈的共价键相结合(如N N等),
当参加化学反应时,必须消耗很大的能量才能形成原子,表现出了单质的稳定性。这种现象不一定说明这种元素的非金属性弱。强的分子内共价键恰是非金属性强的一种表现。
3.比较非金属性强弱的八条依据
(1)元素在周期表中的相对位置
①同周期元素,自左向右,元素的非金属性依次增强,如F>O>N>C>B;Cl>S>P>S i等。
②同主族元素自上而下,非金属性依次减弱,如F>Cl>Br>I;O>S>Se;N>P>As等 。
(2)非金属单质与氢气化合的越容易,非金属性越强。如F2、Cl2、Br2、I2 与H2化合由易到难,所以,非金属性F>Cl>Br>I。
(3)气态氢化物的越稳定,非金属性越强,如稳定性HF>H2O>HCl>NH3>HBr>HI>H2S>PH3,所以非金属性F>O>Cl>N>Br>I>S>P。
(4)最高价氧化物对应的水化物的酸性越强,非金属性越强,如酸性HClO4>H2SO4>H3PO4>H2CO3>H4SiO4,则非金属性Cl>S>P>C>Si。
(5)非金属性强的元素的单质能置换出非金属性弱的元素的单质。如
(6)非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱。常见阴离子的还原性由强到弱的顺序是S2->I->Br->Cl->F-,则非金属性S<I<Br<Cl<F。
(7)与变价金属反应时,金属所呈价态越高,非金属性越强,如Cu+Cl2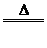 CuCl2;2Cu+S
CuCl2;2Cu+S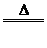 Cu2S,说明非金属性Cl>S。
Cu2S,说明非金属性Cl>S。
(8)几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱,如HClO、HClO3中,氯元素显正价、氧元素显负价,说明氧的非金属性强于氯。
三、非金属元素的化学性质(注意反应条件、现象、生成物的聚集状态)
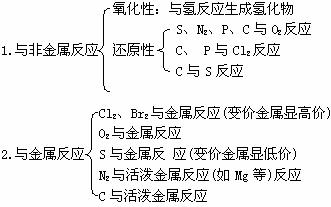


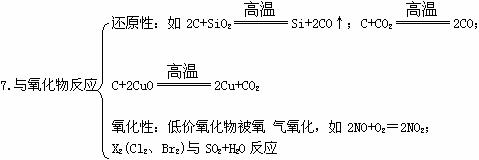
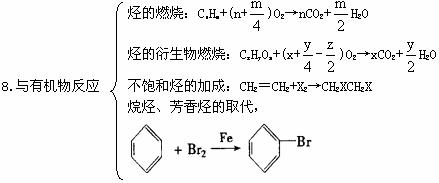
四、常见非全属单质的制取方法
1.电解法
①电解水溶液:如2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
②电解熔融物:如2KHF F2↑+H2↑+2KF
F2↑+H2↑+2KF
2.分解法:如2KClO3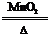 2KCl+3O2↑ CH4
2KCl+3O2↑ CH4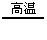 C+2H2 2H2O2
C+2H2 2H2O2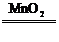 2H2O+O2↑
2H2O+O2↑
3.置换法:如Cl2+2NaBr=2NaCl+Br2 2H2S+O2(不足) 2H2O+2S
2H2O+2S
4.氧化法:如MnO2+4HCl(浓)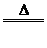 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4NaBr+3H2SO4+MnO2=2Na2SO4+MnSO4+2Br2+3H2O
2H2S+SO2=3S+2H2O
5.还原法:C+H2O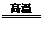 CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2
CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2 Si+2CO↑
Si+2CO↑
试题枚举
【例1】 (1)氰化钾、氰化氢的制备反应式为:K2CO3+C+2NH3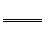 2KCN+3H2O;△H=+276kJ/mol ①
2KCN+3H2O;△H=+276kJ/mol ①
CO+NH3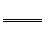 HCN+H2O;△H=+46kJ/mol ②
HCN+H2O;△H=+46kJ/mol ②
氰离子为负一价(CN-),其中碳氮元素的化合价分别为________。 以上两个反应是否均为氧化还原反应?(2)制备纯净无水HCN(沸点299K)的另一种方法是 :混合磨细的KCN和KHS粉末适度加热①试写出这个反应式。②为什么要磨细和用粉末?③为什么要强调适度加热?
解析:据共价键理论,一般当碳同非金属性比它强的元素结合时,碳显正价,氮为负价,为-3价,所以(CN-)中碳为+2价,氮为-3价。故①为氧化还原反应,②为非氧化 还原反应。第二种方法制备HCN是固体与固体之间的反应,故磨细和用粉末的目的是增大表面积,加快反应速率,据题意知,第二种方法制备HCN如温度太低,反应速率较小,温度太高,则酸式盐易分解发生副反应:2KHS
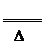 K2S+H2S↑。该反应的化学方程式为KCN+KHS
K2S+H2S↑。该反应的化学方程式为KCN+KHS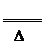 HCN↑+K2S。
HCN↑+K2S。
【例2】 金属M可以在不同条件下发生下列五个反应:M+A→I M+B→H M+C→H+F M+D→H+A M+E→I+G 其中(1)A、B、C、D、E在通常情况下都是气体,并且C是CO 2。(2)上述反应的产物,在不同条件下,还可和有关反应物发生下列反应:F+B→C A +G→E,(3)I是一种离子化合物,它可以水解产生一种白色沉淀和E。该白色沉淀加热可 分解为H和H2O。而E则是分子晶体,其分子中共有10个电子,根据以上条件,判断并写出 有关物质的化学式:A________,B________,C________,D________,E________,F________,G________,H________,I________,M________。
解析: 本题的突破口是M+C→H+F,而C为CO2。一般同CO2能发生反应的金属就现有知识来讲,只能是Mg。F、H中有一为碳,根据F+B→C,则C为CO2,B为气体,F肯定为碳,H为MgO。扫描全题,得知E是分子晶体,且其分子中共有10个电子。分子中有10个电子的有:HF、H2O、NH3、CH4等。而E又通过一种离子化合物水解而得到,E可能为 HF或NH3。如E为HF,根据M+E→I+G,HF同Mg作用,但事实HF同Mg不反应。如为NH3同样根据A+G→E,A为N2或H2。因为Mg可跟A作用,显然A为N2,I为Mg3N2。再根据M+D→H+A,M为Mg,H为MgO,A为N2,则D只能为NO2。
答案:A:N2,B:O2,C:CO2,D:NO2,E:NH3,F:C,G:H2,H:MgO,I:Mg 3N2,M:Mg。
硫及其化合物
考点聚焦
1.硫的物理性质及硫的可燃性。
2.了解二氧化硫与氧气、与水的反应及二氧化硫的实验室制法,认识亚硫酸的不稳定性,认识二氧化硫的漂白作用与次氯酸的漂白作用的区别。
3.知道浓硫酸的强氧化性。
4.学会SO42-的检验方法硫的几种常见价态之间的相互转化硫。
知识梳理
硫位于周期表 周期 族。淡黄色晶体,难溶于水,微溶于酒精,能溶于 。
二、硫的化学性质-
1.硫的可燃性:硫在纯净的氧气中燃烧现象 ,硫的化合价- (填“升高或降低”)
2.汞与硫磺生成硫化汞,因此,实验室常将硫磺撒在汞的表面,以除去不慎洒落的汞。化学方程式为 ,硫的的化合价 (填“升高或降低”)
3.硫与氢气化合生成 ,生成的氢化物比水 (“稳定”还是“不稳定”)
三、SO2
1.SO2的物理性质: 色有 气味 体, 毒 溶于水。
2.SO2的化学性质:(1)具有酸性氧化物的通性:
(2)具有还原性:
(3)具有氧化性 其氧化性比氧气,氯气都弱。
(4)具有漂白性:漂白原理是 和HClO的漂白性的区别 。
★几种物质漂白原理的比较
SO2
氯水、H2O2、Na2O2、O3
活性炭
漂白原理
与有色物质结合生成无色物质
将有色物质氧化为无色物质
吸附有色物质
变化类型
化学变化
化学变化
物理变化
是否可逆
可逆,加热或日久后恢复原来颜色
不可逆,加热或日久后不恢复原来颜色
3. SO2的实验室制法:
反应原理
Na2SO3+ H2SO4== Na2SO4+ SO2↑+H2O(可加热提高反应速率)
Cu+ 2H2SO4
(浓) 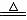 CuSO4+ SO2↑+2H2O
CuSO4+ SO2↑+2H2O
发生装置
固体与液体反应制取气体,发生装置与制Cl2相似
收集方法
向上排空气法
干燥
用浓H2SO4或P2O5酸性干燥剂(不可用碱石灰)
尾气处理
用NaOH等碱溶液吸收多余的二氧化硫气体
4.SO2的危害和治理
SO2是大气主要污染物,直接危害人类身体健康,酸雨为SO2产生的二次污染物。SO2的主要来源为燃烧含硫的燃料(如煤),消除SO2污染的最有效的途径是减少SO2的排放。
SO3是硫的最高价氧化物,为白色易挥发晶体,是典型的酸性氧化物
四、硫酸
浓硫酸除了具有酸的通性外,还具有吸水性、脱水性和强氧化性这三大特性。
(1) 吸水性:吸收游离的水。可作实验室的干燥剂(但不能干燥碱性气体和还原性气体)。
(2) 脱水性:把有机物中的氢、氧两种元素按水的比例脱去。如蔗糖中加入浓硫酸(注意吸水和脱水的区别)。
(3) 强氧化性:浓硫酸的强氧化性还可以与多种物质反应体现。
2H2SO4(浓)+Cu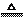 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
2H2SO4(浓)+C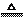 CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
在常温下,浓硫酸跟铁、铝接触时,能在金属表面生成一薄层致密的氧化物,从而阻止内部的金属继续反应,这种现象叫钝化。因此可以用铁或铝贮存浓硫酸(硝酸也具有这一性质)。但是加热条件下可以反应。注意:常温下铁、铝使浓硫酸、浓硝酸钝化(钝化过程是复杂的化学变化),不能理解成“常温下铁、铝使浓硫酸、浓硝酸不发生化学反应”。
五、SO42-检验
被检液中滴入少量 酸化,再加入 ,若产生 ,不可用硝酸酸化,原因是 。
试题枚举
【例1】高温下硫酸亚铁发生如下反应:2FeSO4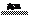 Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是 ( )
Fe2O3+SO2↑+SO3↑若将生成的气体通入氯化钡溶液中,得到的沉淀是 ( )
A.BaSO3和BaSO4 B.BaS
C.BaSO3 D.BaSO4
解析:SO2和SO3通入氯化钡溶液,只有硫酸钡沉淀,因为亚硫酸钡溶于稀硫酸
答案:D
【例2】白色的亚铜化合的Cu(NH4)SO3难溶于水,若与足量的10mol?L-1的硫酸溶
液混合并微热,生成铜和SO2气体及溶液。
(1)完成并配平化学方程式:Cu(NH4)SO3+H2SO4-Cu+SO2+CuSO4+_________
(2)按上述操作,铜的最高转化率是多少_______________
(3)有人设计让上述实验在密闭容器中进行,结果铜的转化率大大提高,问在密闭
容器中进行反应,铜的最高转化率是多少?请说明理由。
解析:(1)上述反应打用逆向配平(歧化反应,铜元素化合价既升高又降低)缺项显然为(NH4)2SO4 ,各计量系数依次为2,2,1,2,1,2,1。
(2)2molCu (NH4)SO3中的铜1mol转化为单质铜,1mol转化为CuSO4,因此,转化率为50%。
(3)若在密闭容器中进行,为何铜的转化率会提高?显然Cu(I)自身岐化转化率只能为50%,必有其它还原剂才能提高其转化率。由于产物中含SO2,SO2具有强还原性,能将Cu(II)还原为零价。其最高转化率可达100%,原因是:每生成1molCuSO4可生成2molSO2,它可提供4mol电子,完全可将CuSO4还原且SO2仍过量。
答案:(1) 2,2,1,2,1,2,1 (2) 50% (3)略
【例3】硫与热强碱溶液可生成S2-和SO32-;生成物继续与硫作用得Sz2-和S2O32-。过滤后除去过量硫,向滤液中加入一定量的强碱后,再适入足量的SO2,SO2与Sz2-也完全转化为S2O32-。问:
(1)S+SO2+OH-完全转化为S2O32-的离子方程式____________________
(2)amolS最终转化为Na2S2O3,需SO2、NaOH的物质的量分别为________
(3)若amolS最终转化为Na2Sz耗原热碱溶液6molNaOH,则Na2Sx中x值为
_________。
 解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①
解析:3S+6OH‑ △ 2S2-+SO32-+3H2O …………①

 S2-+(x+1)S Sx2- ………………②
S2-+(x+1)S Sx2- ………………②
SO32-+S △ S2O32- ……………………③
由①②③迭加得:(2x+2)S+6OH- = 2Sx2-+S2O32-+3H2O …………④
SO2+Sx2-+OH-――S2O32-+H2O ………………⑤
由④⑤迭加得:S+SO2+2OH-=S2O32-+H2O …………………………⑥
答第(1)问时,实质不必要这么繁的过程,因Sx2-、SO32-均为中间产物,只要抓住反应物为S和SO2及OH-,生成物为S2O32-和水即可得反应⑥。
由⑥式可知每有1mol硫需1molSO2和2molOH-,则SO2和OH-分别为a、2amol。
(3)由④式可知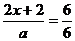 x=
x=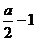
答案:(1) S+SO2+2OH-=S2O32-+H2O (2) a、2amol (3) 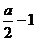
氯及其化合物
考点聚焦
1.知道氯气的物理性质。
2.了解氯气及其化合物的性质
3.知道氯水的消毒和漂白原理
4.学会Cl-的检验方法
5.理解卤族元素原子结构及其单质性质的递变性
知识梳理
一、 氯元素的原子结构与自然界的存在
氯元素位于周期表__周期__族,在自然界中的主要存在形态: 。全球海洋中含盐 左右,主要为 、 。
二、 活泼的氯气
1、氯气的物理性质: 色有 气味的 体, 毒, 溶于水。实验室中应怎样闻气体: 。
2、氯气的化学性质
由氯的原子结构示意图可知氯元素的性质如何?进而能否预测氯气的化学性质又怎样?为什么? 。
① 与金属单质的反应:与钠反应方程式 。现象是 。与
铁反应方程式 。现象是 。与铜反应方程式 。现象是 。
② 与氢气的反应:化学方程式: ,反应现象:氢气在氯气中燃烧 ;氯气与氢气的爆炸实验 。
③Cl2 和红磷反应:化学方程式: ,反应现象 。
结论:分析以上反应中氯元素价态的变化也可得知:氯气是一种强氧化性物质,常氧化剂。
思考:在初中我们是如何定义燃烧的?现在通过氢气与氯气的燃烧实验,你有什么新的认识?
④与水的反应:
与水反应的离子方程式: ,说明:氯气与水反应很微弱,且未可逆反应。
思考:1、氯水的成分 ?(氯水参加反应时,能表现多种性质)2、氯水的保存方法?
⑤次氯酸的性质:
a、一元弱酸(比 弱)
b、强氧化性( 、 、 )
c、不稳定(见光或受热分解):化学方程式: 。
⑥与碱的反应
Cl2 + _NaOH -- 。(常用于除去多余氯气)
离子方程式: 。漂白液主要成分是 。
漂白粉的制法: 。其主要成分: ,有效成分: 。漂粉精的有效成分: 。
漂白原理:ClO-+ H+ = HClO(实际漂白者),Ca(ClO)2 +_HCl(稀)= 。
Ca(ClO)2 +CO2 +H2O = 。
思考:抗洪救灾中防疫部门,向灾民发放的漂白粉片或漂粉精用于饮用水消毒。漂粉精为何要密封保存在阴暗处?
三、 氯离子的检验
1、填写下列表格:
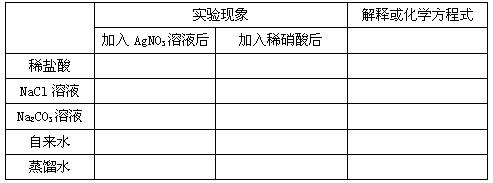
2、原理:被检液中滴入少量 酸化,再滴入 溶液,若产生 ,则可断定溶液中含有氯离子。不可用盐酸酸化,酸化目的是防止( 、 、 、 )影响。
+ AgNO3(aq) → + 稀硝酸 →白色↓
解释:Ag+ + Cl― = AgCl↓
2Ag+ + CO32― = Ag2CO3↓ Ag2CO3 + 2H+ = 2Ag+ + H2O + CO2↑
四、卤族元素
(一)卤素的原子结构
不同点:核电荷数逐渐 ;电子层数逐渐 ;原子半径依次 ,得电子能力逐渐 ;单质氧化性逐渐 。
随卤素核电荷数增加,其原子结构的递变而使卤素单质的物理性质呈规律性变化.
归纳:从F2 →I2
1、颜色逐渐 ,状态从 → → ,密度从 → ,熔沸点由 → (原因是 。
2、单质的溶解性――除氟外(与水剧烈反应)在水中溶解度都较 ,且由 → ,都易溶于有机溶剂,下表列出Cl2、Br2、I2在不同溶剂中的颜色.
水
CCl4
Cl2
Br2
I2
(三)卤素单质的化学性质(相似性及递变性)
由于最外层均为 个电子,极易 电子,因此卤素都是 剂,在自然界均只以 态存在.但随着电子层数递增,原子半径渐 ,核对外层电子的引力渐 ,得电子能力渐 ,其氧化性逐渐 ,主要表现:
。
试题枚举
【例1】下列有关氯的叙述中正确的是
A.液氯和氯水是同一物质
B.红磷在氯气中燃烧产生白色烟雾
C.氯气与水的反应中氯是氧化剂,水是还原剂
D.用氯制漂白粉是为了得到易贮存的漂白剂
解析:液氯、氯水都是液体,但前者是纯氯,后者是氯与水的混合物,时间延长氯水中还逐渐生成盐酸和次氯酸,氯分子渐少,氯离子渐多。如果再有光照, 因分解也在渐少,出现氧气和更多盐酸。氯与水的反应是氯分子中氯原子间发生的自身氧化还原,即歧化反应, 水虽然是反应物,却未参加氧化还原。A、C不正确。
烟是分散在气体中的固体小颗粒,雾是分散在气体里的液体小珠滴。磷在氯气里燃烧的产物三氯化磷是无色液体,可发雾;五氯化磷是浅黄色固体,能形成烟。漂白粉和氯都可以作为漂白剂、消毒剂,且氯更有效。但氯气难贮存,又有剧毒,一般医用、家用的漂白剂和消毒剂使氯气是不合宜的,所以制成漂白粉便于贮存和使用。漂白粉保存得当,如密闭,以防止吸水和 而变质,可以存放较长时间。B、D正确。
答案:B、D。
【例2】 潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,原因是它们均含有 ( )
A. 氯气 B. 次氯酸 C. 次氯酸根 D. 氯化氢
解析 NaClO及Ca(ClO)2的水溶液中,ClO―水解产生HClO无HCl;有色布条的褪色是因HClO的氧化所致。
答案: B
【变式】 用滴管将新制的氯水慢慢滴入盛酚酞的氢氧化钠稀溶液中,当滴到最后一滴时红色突然褪去,发生这一现象的原因可能有两个:
①是由于 (用简要文字说明)
②是由于 (用简要文字说明)
简述用实验方法证明褪色的原因是①还是②
。
【例3】如何鉴别NaCl、NaBr、KI三种白色固体?
解答:
方法一:可用氯水鉴别。
把这三种物质各取少量制成溶液,加入新制的氯水和汽油(或四氯化碳),振荡,分层,使汽油层呈无色的是NaCl;使汽油层呈橙色的是NaBr;呈紫色的是KI。
方法二:可先用焰色反应将KI区分出来。然后再将另外两种物质各取少量制成溶液,加入AgNO3溶液,有白色沉淀生成的是NaCl,有浅黄色沉淀生成的是NaBr。
方法三:直接加入AgNO3溶液。
分别取少量固体制成溶液,分别加入AgNO3溶液,有白色沉淀生成的是NaCl,有浅黄色沉淀生成的是NaBr,有黄色沉淀生成的是KI。
【例4】 多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
卤素
氰
硫氰
①
“单质”
X2
(CN)2
(SCN)2
(OCN)2
酸
HX
HCN
②
HOCN
盐
KX
KCN
KSCN
③
(1)在表中①②③空格处应分别填写_______、_______、_______。
(2)完成下列反应的化学方程式或离子方程式。
①(CN)2和KOH溶液反应的化学方程式为:______________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
解析:此题主要考查“运用已学知识进行类推思维的能力”。解题时可用熟知的Cl2、HCl、KCl等物质作参照物。由还原性Br―<CN―<SCN―,可推知氧化性Br2>(CN)2>(SCN)2,因而可判断(CN)2只能与KSCN反应,不能与NaBr反应,亦即由物质的氧化性和还原性的强弱,可以判断氧化还原反应能否发生。
答案:(1)氧氰 HSCN KOCN
(2)①(CN)2+2KOH====KCN+KOCN+H2O
②(CN)2+2SCN-====2CN-+(SCN)2
该题为信息给予题,给予的信息是:拟卤素〔如(CN)2〕的性质与卤素单质相似,由此而可依据卤素单质的性质来进行类比、模拟来解答习题。这是解答信息给予题的一种方法。
【变式】 溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )
A. IBr是双原子分子
B.在很多反应中IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
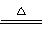
 【例5】在右图的四条直线分别表示钠、镁、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ( )
【例5】在右图的四条直线分别表示钠、镁、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ( )
A. a B. b C. c D. d
解析 Cl2与四种金属反应的均为氧化还原反应,在横坐标上取一点作一条垂直于横坐标的直线,分别与a、b、c、d四条直线的交点即为四种金属与等质量Cl2反应时所需的质量。假设这一点的质量为35.5g,此时金属均转移1mol电子,则消耗四种金属的质量分别为:WNa=23g、WMg=12g、WAl=9g、WFe=18.7g,即等质量氯气消耗四种金属的质量是WNa>WFe>WMg>WAl,故a、b、c、d分别代表Al、Mg、Fe、Na与氯气的反应。
答案:C
氮及其化合物
考点聚焦
1. 知道氮气的物理性质及存在。
2. 能从氮气的结构理解其化学性质。
3. 掌握氮氧化物的重要性质,知道氨的物理性质和用途,掌握氨与水、HCl、O2等的反应。了解氨水的成分及不稳定性。
4. 了解铵盐易溶于水、受热易分解、与碱反应。知道NH4+的检验方法。
5. 掌握氨气的实验室制法。
6. 了解硝酸的化学性质。
知识梳理
一、氮气
1.氮气的结构和物理性质:氮气在空气中约占总体积的 。氮气是无色无味的气体,难溶于水。氮气的电子式 ,结构式为 。氮气的化学性质不活泼,其原因是 。所以氮气可做保护气。但在一定条件下,可与氢气、氧气反应,方程式 。
2.自然界的固氮是把 态的氮转化为 态的氮,如把 转化为一氧化氮。方程式 。
二、氮的氧化物
气体
性质
NO
NO2
状 态
气体
气体
颜 色
无色
红棕色
气 味
无味
刺激性气味
水溶性
不溶
与水反应
实验室制法与收 集
Cu + HNO3(稀)
因会与O2反应,只能排水法收集
Cu+HNO3(浓)
因会与水反应,只能排气法收集
关 系
都是有毒气体,会造成环境污染;会与碳氢化合物作用形成光化学烟雾,也会形成酸雨
三、氨气
1.氨气是 色 气味的气体, 液化, 溶于水。电子式是 ,它的空间构型是 ,是 性分子。
2.氨气是 色有 气味的气体,密度比空气小,易液化,所以常用作制冷剂。极易溶于水。常温常压下,1体积的水能溶解700体积的氨气。(用喷泉实验证明,喷泉实验成功的关键,想一想还有哪些气体能做喷泉实验?)
3.氨气的化学性质:
(1)与水的反应:
思考:氨水和液氨在微粒的组成、性质上有何区别。
(2)与酸的反应:离子方程式为 。
氨水易挥发,不易运输,因此常将其转化为各种固态铵盐加以使用。
4.氨气的实验室制法:
(1)原理:
(2)收集方法: (3)干燥方法:
(4)验满方法 (5)尾气处理:
思考:哪些气体最后要进行尾气处理。
四、铵盐
1.结构: (电子式)
1. 物理性质:都是离子晶体,都易溶于水。
2. 化学性质:(1)受热分解:NH4Cl
NH4HCO3
铵盐的受热分解比较复杂,并非都生成对应的酸和氨气。
(2)与碱的反应:
思考:NH4+的检验:操作为
离子方程式为
五、硝酸
浓、稀硝酸均为强氧化性酸,与金属反应均不产生氢气,但浓硝酸的氧化性更强,浓硝酸一般被还原成NO2,稀硝酸一般被还原成NO;浓硝酸具有挥发性、不稳定性,遇金属铁、铝产生钝化现象;因此保存时要把它盛放在棕色瓶里,储存在阴暗而且温度低的地方。
练习:写出下列化学方程式:
1. 硝酸的不稳定性:
2. 铜与浓硝酸的反应:
3. C与浓硝酸的反应:
4. 与苯的反应:
☆三大强酸的对比
硝酸
硫酸
盐酸
重要物理性质
纯净硝酸为无色液体,常见浓硝酸因溶有分解产生的NO2 而呈黄色,易挥发。能以任意比与水混溶
无色油状液体,难挥发。能以任意比与水混溶
纯净盐酸为无色液体,常见盐酸含有工业杂质(Fe3+)而呈黄色
重要化学性质
强酸性;不稳定性,受热见光易分解;浓稀硝酸均有强氧化性
强酸性;稀硫酸只表现酸性,浓硫酸既表现酸性又表现吸水性、脱水性、强氧化性
强酸性;还原性(浓度越大还原性越强)
实验室制法
硝酸钠与浓硫酸微热
氯化钠与浓硫酸强热
工业制法
NH3 ~NO~NO2 ~HNO3 注:NO循环氧化吸收
FeS2~2SO2 ~2SO3 ~2H2SO4
注:SO2 循环氧化吸收
H2 在Cl2 中燃烧生成的HCl 用水吸收
☆关于浓酸变稀的问题
从上表中可看出三大强酸有一个共同的特点――浓度不同时所表现的性质有所不同,记住此点会给我们解题带来重要突破。记住下列反应:
4HNO3(浓) + Cu = Cu(NO3)2 + 2NO2 ↑+ 2H2O
8HNO3(稀) + 3Cu = 3Cu(NO3)2 + 2NO↑+ 4H2O
2H2SO4(浓)+ Zn = ZnSO4 + SO2 ↑+2H2O
H2SO4(稀) + Zn = ZnSO4 + H2 ↑
 4HCl (浓 + MnO2
MnCl2 +Cl2
↑+2H2O
4HCl (浓 + MnO2
MnCl2 +Cl2
↑+2H2O
试题枚举
【例1】Murad等三位教授提出NO在人体内有独特的功能,关于NO的叙述正确的是
①NO可以是某些含低价氮物质氧化的产物
②NO不是亚硝酸酐
③NO可以是某些含高价氮物质还原的产物
④NO是无色气体
A.全部 B.①③④
C.②③④ D.①④
解析:NO中氮的化合价处于中间价态,它可以是还原产物,如HNO3→NO,也可以是氧化产物,如NH3→NO;HNO2的酸酐是N2O3;NO是无色气体。所以,所给的几种说法都正确。
答案: A
【例2】“摇摇冰”是一种即用冷的饮料,吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会致冷。该化学物质是
A NaCl B NH4NO3(s) C NaOH(s) D CaO(s)
解析:溶解过程中伴随着能量的变化,固体硝酸铵溶于水吸热,使温度降低,固体氢氧化钠溶于水放热,使溶液温度升高,生石灰与水的反应也放出大量的热,氯化钠溶解过程中能量的变化很小。
答案:B
【例3】同温同压下,在3支相同体积的试管中分别充有等体积的2种气体,它们是(1)NO和NO2(2)NO2和O2(3)NH3和N2。现将3支试管均倒置于水槽中,充分反应后剩余气体的体积分别是V1、V2、V3,则下列关系正确的是
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3>V1 D. V3>V1>V2
解析:设每种气体的体积为1体积,则:(1)中剩余1+(1/3)=4/3体积气体;(2)中剩余3/4体积的氧气;(3)中剩余1体积的N2.
答案:B
在进行氮氧化物计算时,要注意有关循环氧化、由多步反应合并所得总反应的应用。记注下列反应:
4NO2 + O2 + 2H2O = 4HNO3 4NO +3O2 + 2H2O = 4HNO3
NO2 + NO + 2NaOH = 2NaNO2 + H2O 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
【变式】在一定温度和压强下,将装有N2和NO2混合气体的试管倒立于水中,足够时间后,试管内气体体积缩小为原来体积的3/5,则远混合气体中N2和NO2的体积比
A.2:3 B.3:2 C.3:5 D.5:3
答案:A
碳、硅及其化合物
考点聚焦
1. 掌握C、CO、CO2的重要性质以及实验室制取、检验CO2方法。
2. 知道 硅在自然界中的存在形态,主要用途。
3. 能利用晶体结构理论来解释硅和二氧化硅的物理性质,了解它们的化学性质。
4. 了解陶瓷、玻璃、水泥等硅酸盐产品的用途。
知识梳理
一、硅(Si)
1.硅的存在:在自然界只有化合态,是一种亲氧元素(这与同主族的碳不同),一般以SiO2 或 的形式存在,在地壳中的含量仅次于氧。
2.结构:与金刚石的晶体结构类似,是正四面体型空间网状结构的原子晶体。
3.物理性质:灰黑色,硬度大,熔沸点高,具有金属光泽。
4.化学性质:常温下与F2、HF、NaOH反应:
加热时能与H2化合生成不稳定的氢化物。
5.用途:(1)良好的半导体材料(为什么?)
(2)太阳能电池
(3)计算机芯片
二、二氧化硅(SiO2)
1.存在:天然SiO2也叫硅石,自然界中的石英玛瑙(含杂质的石英)的主要成分都是SiO2。。
2.结构:一个硅原子与4个氧原子形成4个共价键,即每个硅原子周围有4个氧原子,每个氧原子周围有2个硅原子;晶体中硅原子和氧原子以1:2组成空间立体网状结构,是原子晶体。
3.化学性质:(1)酸性氧化物:与强碱反应:
离子方程式: (保存碱性溶液不能用橡胶塞)。与碱性氧化物反应: 。
(2)与HF反应: (唯一与其反应的酸)。
4,用途:(1)制造光导纤维
(2)石英坩埚
(3)光学仪器和工艺品
三、硅胶
1. 制法: 。
2. 性质: 。
试题枚举
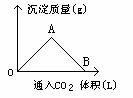 【例1】右图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与CO2体积的关系曲线,试回答:
【例1】右图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与CO2体积的关系曲线,试回答:
(1)OA段曲线与AB段曲线所表示的反应方程式为OA:__________,AB_____________。
(2)A点已参加反应的CO2和Ca(OH)2的物质的量之比为______________。
(3)B处溶液中存在的浓度较大的两种离子是_______和________(填离子符号),将B处生成的溶液煮沸可见到的现象是_______________
解析:CO2与Ca(OH)2反应,CO2的量直接影响产物的生成,图形较清楚地反映了这一关系,依据有关反应原理:
CO2(少)+Ca(OH)2== CaCO3↓+H2O ,
AB段:CO2+CaCO3+H2O== Ca(HCO3)2
便可判断图形中各段所发生的反应,OA段随着CO2继续通入CaCO3的量逐渐增大,A点达到沉淀最大值,AB段随CO2的继续通入,生成的CaCO3不断溶解转化为Ca(HCO3)2,B点CaCO3全溶解,溶液又变得澄清。
答案:(1)OA段:CO2+Ca(OH)2== CaCO3↓+H
AB段:CO2+CaCO3+H2O== Ca(HCO3)2
(2)A点:n(CO2)∶n[Ca(OH)2]=1∶1
(3)Ca2+ HCO3- 因Ca(HCO3)2受热分解,溶液变浑浊,有气泡逸出。
【例2】下列关于硅的说法不正确的是 ( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
D.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气、氢气等非金属反应
解析: 常温下,硅可与氟气、氢氟酸、强碱溶液反应,加热和高温条件下,硅能与氧气、氢气起反应。选C。
答案: C
【例3】石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备破坏。这是由于石墨( )
A . 有放射性 B. 易燃、易爆 C. 能导电 D. 有剧毒
解析:利用了石墨的导电性能,石墨纤维落在输电线上,造成线路短路,发电机和其他设施损坏。石墨性质稳定,无毒也不易燃、易爆。
答案: C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com