2009年江苏省如皋海安第一学期期末调研试卷 高一化学
高一化学
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Mg-24 Al-27 Si-28
第一卷(选择题共50分)
一、选择题(本题包括10小题,每题3分,共30分。每小题只有一个选项符合题意)
1.加强食品检测是保证食品安全、保护公众利益的重要举措。下列一般不属于食品安全检测指标的是
A.氯气 B.二氧化硫 C.亚硝酸钠 D.碘酸钾
试题详情
2.食盐分散到酒精中形成直径在1nm~l00nm之间的超细粒子,这样的分散系是
A.悬浊液 B.溶液 C.胶体 D.乳浊液
试题详情
3.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:
①Cu与HNO3 ②Cu与FeCl3溶液 ③Zn与H2SO4 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是
A.①② B.①③ C.③④ D.②④
试题详情
4.气体体积的大小与许多因素有关。当温度和压强相同时,气体体积主要取决于
A.气体的种类
B.气体的物质的量
C.气体分子本身的大小 D.气体分子之间的平均距离
试题详情
5.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中获取MgCl2
C.提取镁的过程涉及化合、分解、置换反应
D.第④步电解时,还会产生副产品氯气
试题详情
6.菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷。下列说法正确的是
A.五价砷在维生素C作用下发生了还原反应
B.“两者同食”发生的反应中维生素C作氧化剂
C.因为河虾中含有砷元素,所以不能食用
D.可以推测砒霜中所含的砷元素化合价为+5
试题详情
7.氮化硅(Si3N4)是一种具有耐高温耐磨蚀等优异性能的新型陶瓷。工业上可用下列方法制取:3SiO2+6C+2N2 Si3N4+6CO。下列说法正确的是
Si3N4+6CO。下列说法正确的是
A.氮化硅陶瓷可用于制造汽车发动机
B.氮化硅陶瓷是良好的半导体材料
C.氮化硅陶瓷属于传统硅酸盐产品
D.氮化硅可改写成3SiO2?2NO2形式
试题详情
8.下图为含有同一种元素的a、b、c、d四种物质的转化关系。其中a是单质,b、c是氧化物,d是酸,则a可能是①C ②N2 ③S
④F2中的
试题详情

A.①和③ B.只有④ C.①②③ D.①②③④
试题详情
9.下列实验方法不正确的是
A.用丁达尔现象鉴别颜色相似的浓溴水和Fe(OH)3胶体
B.用KMnO4溶液检验Fe2(SO4)3溶液中是否含有Fe2+
C.用等物质的量浓度盐酸可以鉴别Na2CO3和NaHCO3固体
D.用直接观察溶液灼烧的焰色可证明溶液中是否只含有Na+
试题详情
10.在一定温度下,1 mol金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的量之比为1:3,则反应过程中转移的电子总数为
A.2 mol B.3 mol C.4mol D.5 mo1
试题详情
二、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11.在使用容量瓶配制溶液时,下列操作不正确的是
A.使用容量瓶前都必须检查容量瓶是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.称好的固体试样需用纸条小心地送入容量瓶中
D.摇匀后发现凹液面下降,不加水至刻度线
试题详情
12.用NA 表示阿伏加德罗常数的值,下列说法中正确的是
试题详情
A.标准状况下,22.4LCO2气体中含氧原子数目为2NA
B.1mo1?L―1的A1C13溶液中,C1―离子的数目为3 NA
C.任何条件下,23gNa+离子含有的最外层电子数为NA
D.60g的二氧化硅可与水反应生成硅酸的分子数为NA A
13.下列反应的离子方程式书写正确的是
A.氯气和水的反应:C12+H2O=2H++C1―+ClO―
B.向A12(SO4)3溶液中加入过量的氨水:A13++3NH3?H2O=A1(OH)3↓+3NH4+
C.FeCl2溶液中通入C12:Fe2++C12=Fe3++2C1―
D.铜片加入稀硝酸中:3Cu+2NO3―+8H+=3Cu2++2NO↑+4H2O
试题详情
14.某溶液中含有大量的下列离子:Fe3+、SO42―、A13+和M离子,经测定Fe3+、SO42―、A13+和M离子的物质的量之比为2:4:1:1,则M离子可能是下列中的
A.Na+ B.OH― C.S2― D.C1―
试题详情
15.右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部
硫酸化学纯(CP) (500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98
试题详情
试题详情
A.该硫酸试剂的物质的量浓度为18.4mol?L―1 B.该硫酸与等体积的水混合所得溶液的质量分数小于49% 试题详情
C.配制200.0mL
4.6mol?L-1的稀硫酸需取该硫酸50.0mL 试题详情
D.2.7gAl与足量的该硫酸反应可得到标准状况下的H2 3.36L 第二卷(非选择题共50分) 试题详情
三、(本题包括2小题,共20分) 16.(8分)海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: 试题详情

请填写下列空白: (1)步骤⑤的实验操作名称是
。 (2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是
。 试题详情

(3)步骤④反应的离子方程式是
。 (4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘: 。 试题详情
17.(12分)某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置。 试题详情

请回答下列问题: (1)实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式并用单线桥标出电子转移的方向和数目。
(2)洗气瓶B的作用是
。c、E都是干燥装置,其中E中干燥管内所装的试剂是
(3)反应开始后装置D中出现浓厚的白烟并在容器内壁凝结,活动小组拟继续通过实验鉴定该固体的成分。请你协助他们完成该实验探究。Tesoon 步骤①:取固体样品加少量水溶解,分装于两支试管中。向其中一支试管中加入浓NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口附近,红色石蕊试纸变蓝,证明该固体中含有
步骤②:
(4)从绿色化学的角度考虑该装置中有一明显不合理之处,请你提出改进的意见。
试题详情
四、(本题包括2小题,共16分) 18.(8分)下图为一些常见物质的转化关系图(部分反应物与生成物未标出)。A、H为单质,其中H为气体;B、E为无色液体,F为淡黄色固体,K为红褐色固体;D的大量排放是形成酸雨的重要原因。 试题详情
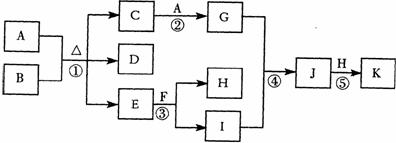
回答下列问题: (l)在常温下,A和B发生的变化称为
。 (2)实验室制取F的方法是
。 (3)向C溶液中通入D,也能实现C→G的转化,则该反应的离子方程式是 。 (4)反应⑤化学方程式是
试题详情
19.(8分)离子反应是中学化学中重要的反应类型。回答下列问题: (1)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下左图。下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是
试题详情

(2)将NaBr溶液加入AgC1沉淀中,产生AgBr黄色沉淀。从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是
。 (3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。www.tesoon.com 反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2 错误观点 离子方程式 ① 所有的离子方程式均可以表示一类反应 ② 所有酸碱中和反应均可表示为: H++OH-=H2O 五、(本题包括2小题,共14分) 试题详情
20.(6分)将一定量的NaHCO3和Na2CO3的混合物放在密闭的容器中加热,充分反应后,测得容器中CO2的体积为1.12L(标准状况)。将反应后的固体与200mL某浓度的盐酸恰好完全反应,转化为4.48LCO2。试回答: (1)盐酸的物质的量浓度为
。 (2)求原混合物中NaHCO3与Na2CO3的质量比
。 试题详情
21.(8分)某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金。 (1)设计一个最简单的实验方案,证明上述所得的块状熔融物中含有金属铝。写出表示该实验原理的离子方程式:
。 试题详情
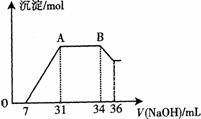 (2)某同学取一定量上述的熔融物与过量的、且很稀的硝酸充分反应,发现反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mo1?L―1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mo1)的关系如图所示。在AB段,有刺激性气味的气体产生。 (2)某同学取一定量上述的熔融物与过量的、且很稀的硝酸充分反应,发现反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mo1?L―1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mo1)的关系如图所示。在AB段,有刺激性气味的气体产生。
试回答下列问题: ①熔融物与稀硝酸充分反应后,还原产物NH4NO3的物质的量为
。 ②熔融物中金属铝的物质的量为
;金属铁的物质的量为
。 试题详情
一、选择题 1、D 2、C 3、B 4、B 5、C 6、A 7、A 8、C 9、B 10、A 二、选择题 11、BC 12、A 13、BD 14、D 15、AC 三、(本题包括2小题,共20分) 16.(8分) (1) 萃取 。 (2) C 。 (3)是 2H2O2+2I―+2H+=I2+2H2O 。 (4)向提取碘后的水溶液中加入淀粉溶液看溶液是否变蓝,判断溶液中是否含有单质碘。 17.(12分)   
△ (1) 4HCl+MnO2====MnCl2+Cl2↑+2H2O (2) 除去Cl2中的HCl 。 碱石灰 (3) 步骤①: NH4+
步骤②:
向另一支试管中加入硝酸酸化的硝酸银溶液,若产生白色沉淀,说明溶液中含有Cl―离子 (4)将D装置的竖直导管口套一个气囊收集尾气,以防尾气污染环境 四、(本题包括2小题,共16分) 18.(8分) (l) 钝化 。 (2) 钠在空气中燃烧 。 (3) SO2+2Fe3++2H+====2Fe2++4H++SO42―
。 (4) 4Fe(OH)2+O2+2H2O=4Fe(OH)3
19.(8分) (1) C A
B (2) AgCl
。 (3) 错误观点 离子方程式 ① 所有的离子方程式均可以表示一类反应 2Na+2H2O=2Na++2OH―+H2↑ ② 所有酸碱中和反应均可表示为: H++OH-=H2O 2H++SO42―+Ba2++2OH―=Ba(OH)2↓+2H2O 五、(本题包括2小题,共14分) 20.(6分) (1) 2.0mol/L 。 (2) 84:159 。 21.(8分) (1) 2Al+2H2O+2OH―==2Al2―+3H2↑
。 (2) ① 0.012mol 。②
0.008mol ;
0.024mol 。  天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com)
版权所有 天星教育网(www.tesoon.com)
版权所有
Tesoon.com 天星版权 天?星om 权 
天?星om 权 天?星om 权 Tesoon.com 天星版权
| | | | | | | |

 高一化学
高一化学 Si3N4+6CO。下列说法正确的是
Si3N4+6CO。下列说法正确的是