
科目:gzhx 来源: 题型:
| 试管A | 试管B | |
| 加入试剂 | ||
| (预期)实验现象 (褪色时间) |
||
| 结论 | 猜想Ⅱ正确 | |
科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
科目:gzhx 来源: 题型:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
科目:gzhx 来源:2010—2011学年广东省广州六中高二上学期期末考试化学试卷卷 题型:实验题
(10分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ — Mn2++ CO2↑+ H2O(未配平)
现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| I | 2 mL | 20 | |
| II | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| III | 2 mL | 30 | |
| IV | 1 mL | 20 | 1 mL蒸馏水 |
科目:gzhx 来源:2015届广东省高二上学期期中考试理科化学试卷(解析版) 题型:选择题
下列有关化学反应速率的说法中,正确的是
A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率
C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,为了加快反应速率,实际生活中使用了增大压强或升高温度的方法。
科目:gzhx 来源:2014届山东省高二10月月考化学试卷(解析版) 题型:实验题
(15分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:① 在酸性环境下的还原产物是
在酸性环境下的还原产物是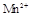 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液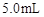 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
|
实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸溶液 |
|
|
褪色时间 |
|
1 |
65℃ |
— |
— |
1.0mL |
100s |
|
2 |
65℃ |
10滴 |
— |
1.0mL |
90s |
|
3 |
75℃ |
10滴 |
— |
1.0mL |
40s |
|
4 |
75℃ |
10滴 |
加入少许 |
1.0mL |
3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体 样品
样品 ;配制成
;配制成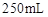 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述 溶液与酸性
溶液与酸性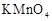 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
科目:gzhx 来源:2012-2013学年山东省冠县武训高中高二10月月考化学试卷(带解析) 题型:实验题
(15分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:①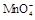 在酸性环境下的还原产物是
在酸性环境下的还原产物是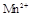 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 | 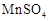 固体 固体 |   溶液 溶液 | 褪色时间 |
| 1 | 65℃ | — | — | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | — | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | — | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
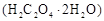 样品
样品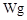 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答: 溶液与酸性
溶液与酸性 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。科目:gzhx 来源:2011-2012学年福建省南安市侨光中学高二上学期期末考试化学试卷 题型:填空题
(8分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H 2C2O4 + H+ ——Mn2++ CO2↑+ H2O(未配平)
用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H 2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| I | 2 mL | 20 | |
| II | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| III | 2 mL | 30 | |
| IV | 1 mL | 20 | 1 mL蒸馏水 |
科目:gzhx 来源: 题型:
(10分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ — Mn2+ + CO2↑+ H2O(未配平)
现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| I | 2 mL | 20 |
|
| II | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| III | 2 mL | 30 |
|
| IV | 1 mL | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为 。
(2)如果研究催化剂对化学反应速率的影响,使用实验 和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(3)对比实验I和IV,可以研究 对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 。
科目:gzhx 来源:2012-2013学年广东省广州六中高二上学期期末考试理科化学试卷(带解析) 题型:单选题
下列有关化学反应速率的说法中,正确的是
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,若升高温度,则吸热反应速率增大,放热反应速率减小 |
科目:gzhx 来源:2012届广东省高二上学期期末考试化学试卷卷 题型:实验题
(10分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ — Mn2+ + CO2↑+ H2O(未配平)
现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
|
组别 |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
|
I |
2 mL |
20 |
|
|
II |
2 mL |
20 |
10滴饱和MnSO4溶液 |
|
III |
2 mL |
30 |
|
|
IV |
1 mL |
20 |
1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为 。
(2)如果研究催化剂对化学反应速率的影响,使用实验 和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(3)对比实验I和IV,可以研究 对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 。
科目:gzhx 来源:2014届湖北省高二9月调研考试化学试卷(解析版) 题型:实验题
(13分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:① 在酸性环境下的还原产物是
在酸性环境下的还原产物是 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液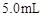 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
|
实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸溶液 |
|
|
褪色时间 |
|
1 |
65℃ |
— |
— |
1.0mL |
100s |
|
2 |
65℃ |
10滴 |
— |
1.0mL |
90s |
|
3 |
75℃ |
10滴 |
— |
1.0mL |
40s |
|
4 |
75℃ |
10滴 |
加入少许 |
1.0mL |
3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体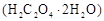 样品
样品 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述 溶液与酸性
溶液与酸性 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
科目:gzhx 来源:2012-2013学年湖北省孝感高中高二9月调研考试化学试卷(带解析) 题型:实验题
(13分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:① 在酸性环境下的还原产物是
在酸性环境下的还原产物是 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液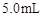 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 |  固体 固体 |   溶液 溶液 | 褪色时间 |
| 1 | 65℃ | — | — | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | — | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | — | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
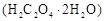 样品
样品 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答: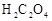 溶液与酸性
溶液与酸性 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。科目:gzhx 来源:2015届广东省广州市四校高二上学期期末联考化学试卷(解析版) 题型:实验题
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大。小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证。
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
【实验目的】探究草酸与高锰酸钾反应的速率变化“异常”原因
【实验用品】仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;
试剂:0.1mol/L H2C2O4溶液、0.05mol/L KMnO4(硫酸酸化)溶液等。
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容。
(1)草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为(已知:MnO4_还原产物是Mn2+) 。
(2)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是 。
(3)猜想Ⅱ可能是______________________________________________________________。要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂及一种仪器,分别是 。
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
|
|
试管A |
试管B |
|
加入试剂 |
|
|
|
(预期)实验现象 (褪色时间) |
|
|
|
结论 |
猜想Ⅱ正确 |
科目:gzhx 来源:2014届广东省高二上学期期末考试理科化学试卷(解析版) 题型:选择题
下列有关化学反应速率的说法中,正确的是
A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率
C.在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,若升高温度,则吸热反应速率增大,放热反应速率减小
科目:gzhx 来源:2012-2013学年山东省冠县武训高中高二10月月考化学试卷(带解析) 题型:实验题
(15分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:① 在酸性环境下的还原产物是
在酸性环境下的还原产物是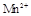 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 |  固体 固体 |  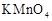 溶液 溶液 | 褪色时间 |
| 1 | 65℃ | — | — | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | — | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | — | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
 样品
样品 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答: 溶液与酸性
溶液与酸性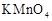 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。科目:gzhx 来源: 题型:阅读理解
某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应如下:
4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。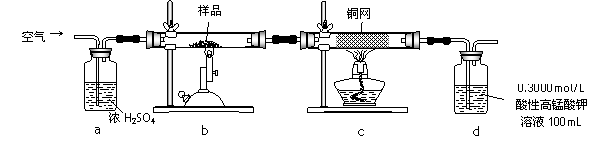
实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。
(已知:5SO2 + 2KMnO4 + 2H2O == K2SO4 + 2MnSO4 + 2H2SO4 )
请回答下列问题:
(1)称量样品质量能否用托盘天平_______(填“能”或“不能”),取出d中溶液10mL需要用______准确量取(填序号)
A.容量瓶 B.量筒 C.碱式滴定管 D.酸式滴定管
 (2)上述反应结束后,仍需通一段时间的空气,其目的是_______________________________
(2)上述反应结束后,仍需通一段时间的空气,其目的是_______________________________
(3)已知草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为_______________________________________﹔判断滴定到达终点的方法是_____________________________________________
(4)已知滴定管初读数为0.10mL,末读数如右图所示,消耗草酸溶液的体积为___________mL,
下列操作会导致该样品中FeS2的纯度测定结果偏高的是_________(填序号)
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)该样品中FeS2的纯度为__________________
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是_______(填编号)
 |
科目:gzhx 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H2C2O4 + H+ — Mn2+ + CO2↑+ H2O(未配平)
现用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| I | 2 mL | 20 | |
| II | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| III | 2 mL | 30 | |
| IV | 1 mL | 20 | 1 mL蒸馏水 |
科目:gzhx 来源:2010年浙江省高考化学模试试卷(解析版) 题型:解答题