合成氨反应N2(g)+3H2(g)=2NH3(g)答案解析
科目:gzhx
来源:
题型:阅读理解
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”)
不改变
不改变
.
(2)一定温度下,在恒容密闭容器中N
2O
5可发生化学反应:2N
2O
5(g)⇌4NO
2(g)+O
2(g)△H>0
①下表为反应T
1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| C(N2O5)/mol•L-1 |
5.00 |
3.52 |
2.48 |
则500s内N
2O
5的分解速率为
0.00296 mol•L-1•S-1
0.00296 mol•L-1•S-1
.
②在T
2温度下,反应1000s时测得NO
2的浓度为4.98mol•L
-1,则T
2<
<
T
1(填“>”“<”“=”)
(3)已知肼分子(H
2N-NH
2)可以在氧气中燃烧生成氮气和水.
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
N2H4-4e-+4OH-=N2+4H2O
N2H4-4e-+4OH-=N2+4H2O
;
②用电离方程式表示肼的水溶液呈碱性的原因
H2N-NH2•H2O⇌H2N-NH3++OH-
H2N-NH2•H2O⇌H2N-NH3++OH-
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N
2H
4(l)+2H
2O
2(l)═N
2(g)+4H
2O(g)△H=-642.2kJ•mol
-1因此肼可以作为火箭推进剂.根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼
不可以
不可以
.说明原因
因为该反应的逆反应是吸热反应,即△H>0,且熵减小,属于不自发反应,故不能用氮气和水来制取肼
因为该反应的逆反应是吸热反应,即△H>0,且熵减小,属于不自发反应,故不能用氮气和水来制取肼
.
查看答案和解析>>
科目:gzhx
来源:
题型:
下列说法正确的是( )
| A、对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | B、氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | C、合成氨反应N2(g)+3H2(g)⇌2NH3(g)△H<0,加入催化剂能加快反应速率并提高转化率 | D、25℃Ksp[Al(OH)3]=2×10-33,Ksp(AlPO4)=1.310-20,在各自的饱和溶液中,c(Al3+)前者小 |
查看答案和解析>>
科目:gzhx
来源:
题型:
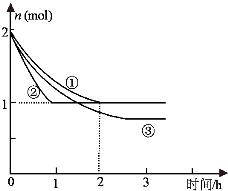
合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g)△H=-94.2kJ•mol
-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N
2、H
2和NH
3的物质的量分别为2mol、6mol、0mol,N
2的物质的量随时间的变化如图所示.
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件是:②
;③
;
(2)实验①的平衡常数K=
(用最简分数表示),该反应进行到2h时的平均反应速率v(H
2)=
;
(3)氨是工业合成尿素(H
2NCONH
2)的重要原料,工业上合成尿素的反应分为如下两步:
第1步:2NH
3(l)+CO
2(g)═H
2NCOONH
4(氨基甲酸铵)(l)△H
1=-330.0kJ•mol
-1第2步:H
2NCOONH
4(l)═H
2O(l)+H
2NCONH
2(l)△H
2=+226.0kJ•mol
-1则2NH
3(l)+CO
2(g)═H
2O(l)+H
2NCONH
2 (l)△H=
.
(4)工业上利用反应 3Cl
2+2NH
3═N
2+6HCl检查氯气管道是否漏气.当转移6mol 电子时,生成氮气在标准状况下的体积是
L.
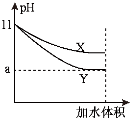
(5)相同pH的氨水和NaOH溶液加水稀释相同的倍数,pH变化曲线如图所示,则x曲线代表的物质是
,当a=9时,稀释后溶液的体积是稀释前溶液体积的
倍.
查看答案和解析>>
科目:gzhx
来源:
题型:
已知合成氨反应N2(g)+3H2(g)⇌2NH3(g)△H<0,工业上选择的适宜条件为:500℃、铁作催化剂、2×107~5×107Pa.下列说法正确的是( )
查看答案和解析>>
科目:gzhx
来源:
题型:
(2009•山东)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N
2 (g)+3H
2(g)=2NH
3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂
不改变
不改变
反应的△H(填“增大”“减小”或“不改变”).
(2)已知:O
2 (g)=O
2+(g)+e-△H
1=1175.7kJ•mol
-1PtF
6(g)+e-
=PtF
6-(g)△H
2=-771.1kJ•mol
-1O
2+P
tF
6-(S)=O
2+ (g)+P
tF
6-(g)△H
3=482.2kJ•mol
-1则反应O
2(g)+PtF
6(g)=O
2+P
tF
6-(S) 的△H=
-78.2
-78.2
kJ•mol
-1.
(3)在25℃下,向浓度均为0.1mol•L
-1的MgCl
2和CuCl
2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为
2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+
2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+
.已知25℃时K
sp[Mg(OH)
2]=1.8×10
-11,K
sP[Cu(OH)
2]=2.2×10
-20.
(4)在25℃下,将a mol•L
-1的氨水与0.01mol•L
-1的盐酸等体积混合,反应平衡时溶液中c(NH
4+)=c(Cl
-).则溶液显
中
中
性(填“酸”“碱”或“中”);用含a的代数式表示NH
3•H
2O的电离常数K
b=
.
查看答案和解析>>
科目:gzhx
来源:
题型:
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡
左
左
移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H
不改变
不改变
(填“增大”、“减小”或“不改变”).
(2)在25℃下,向浓度均为0.1mol•L
-1的MgCl
2和CuCl
2混合溶液中逐滴加入氨水,沉淀会分步析出.
首先生成沉淀的离子方程式为
Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+
Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+
氨水过量后,生成的沉淀会部分溶解,写出溶解沉淀的离子方程式
Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O
Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O
.
(已知25℃时K
sp[Mg(OH)
2]=1.8×10
-11,K
sP[Cu(OH)
2]=2.2×10
-20)
(3)在25℃下,将a mol•L
-1的氨水与0.01mol•L
-1的盐酸等体积混合,反应后溶液中
c(NH
4+)=c(Cl
-).则溶液显
中
中
性(填“酸”、“碱”或“中”),请用含a的代数式表示NH
3•H
2O的电离常数K
b=
.
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO
2和0.10molO
2,半分钟后达到平衡,测得容器中含SO
30.18mol,则v(o
2)=
0.036
0.036
mol.L
-1.min
-1:若继续通入0.20mol SO
2和0.10mol O
2,再次达到平衡后,n(SO
3)的取值范围为
0.36mol<n(SO3)<0.4mol
0.36mol<n(SO3)<0.4mol
.
查看答案和解析>>
科目:gzhx
来源:
题型:
已知合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g)△H=-92.30kJ•mol
-1,在某温度下2L的密闭容器中进行,测得如下数据:
时间(h)
物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
n5 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
n6 |
| NH3 |
O |
O.20 |
n2 |
1.OO |
1.OO |
下列说法正确的是( )
| A、反应3h内,反应速率秒v(N2)为O.17 mol•L-1•h-1 |
| B、此温度下,该反应的平衡常数为O.037 |
| C、反应进行到1小时时放出的热量为9.23 kJ |
| D、4h时,若再加入1 molN2,达到新的化学平衡时,N2的转化率是原来的两倍 |
查看答案和解析>>
科目:gzhx
来源:
题型:
在四个不同的容器中,分别进行不同条件下的合成氨反应N2(g)+3H2(g)⇌2NH3(g).在相同时间内表示该反应速率最快的是( )
| A、v(H2)=0.1mol/(L•s) | B、v(N2)=0.1mol/(L•s) | C、v(N2)=0.2mol/(L•s) | D、v(NH3)=0.3mol/(L•s) |
查看答案和解析>>
科目:gzhx
来源:
题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g)△H<0,若在恒温、恒压条件下向平衡体系中通入氩气,平衡
移动(填“向左”、“向右”或“不”);使用催化剂
反应的△H(填“增大”、“减小”或“不改变”).
(2)在固定体积的密闭容器中,进行反应:N
2(g)+3H
2(g)⇌2NH
3(g)△H<0,其化学平衡常数K与t的关系如下表:
| t/(K) |
298 |
398 |
498 |
… |
| K/(mol•L-1)-2 |
4.1×106 |
K1 |
K2 |
… |
则该反应平衡常数K的表达式为
,试确定K
1的相对大小,K
1
4.1×10
6(填写“>”、“=”或“<”).
(3)在25℃下,浓度分别为0.1mol•L
-1的氨水与盐酸等体积混合恰好完全反应.
①NH
3•H
2O的电离常数表达式K
b=
.
②反应后溶液pH<7,原因是
(用离子方程式表示);用pH试纸测定该溶液pH的操作方法为
.
③反应后的溶液中各离子浓度由大到小的顺序为
.
查看答案和解析>>
科目:gzhx
来源:
题型:
对于合成氨反应N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1 下列图象正确的是( )
查看答案和解析>>
科目:gzhx
来源:
题型:
运用化学反应原理研究以下问题:
(1)合成氨反应N
2(g)+3H
2(g)

2NH
3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
向左
向左
移动(填“向左”、“向右”或“不”),平衡常数K
不变
不变
(填“变大”、“变小”或“不变”);使用催化剂
不改变
不改变
反应的△H(填“增大”、“减小”或“不改变”).
(2)在25℃时,向浓度均为0.1mol•L
-1的MgCl
2和CuCl
2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为
Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+
Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+
.(已知25°CK
sp[Mg(OH)
2]=1.8×10
-11,K
sp[Cu(OH)
2]=2.2×10
-20)
(3)在25℃时,将a mol•L
-1的氨水与0.01mol•L
-1的盐酸等体积混合,反应平衡时溶液中c(NH
4+)=c(Cl
-),则溶液显
中
中
性(填“酸”、“碱”或“中”);且a
>
>
0.01(填“>”、“=”或“<”).
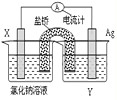
(4)依据反应:Cu
2+(aq)+Fe(s)═Fe
2+(aq)+Cu(s) 设计的原电池如图所示:
电极X的材料是
Fe
Fe
;电解质溶液Y是
硫酸铜溶液或氯化铜溶液等
硫酸铜溶液或氯化铜溶液等
;若Y为氯化钠溶液,则经过一段时间,发现X极上出现锈斑,则此过程中正极的电极反应式为
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.
查看答案和解析>>
科目:gzhx
来源:
题型:阅读理解
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H
不改变
不改变
(填“增大”“减小”或“不改变”).
(2)甲烷在高温下与水蒸气反应的方程式为:CH
4+H
2O=CO+3H
2.已知部分物质燃烧的热化学方程式如下:
2H
2(g)+O
2(g)=2H
2O(l)△H=-571.6kJ•mol
-12CO(g)+O
2(g)=2CO
2(g)△H=-566kJ•mol
-1CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(l)△H=-890.3kJ•mol
-1又知1molH
2O(g)转变为1mol H
2O(l)时放出44.0kJ热量.写出CH
4和H
2O在高温下反应的热化学方程式
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ•mol-1
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ•mol-1
.
(3)在25℃下,向浓度均为0.1mol•L
-1的MgCl
2和CuCl
2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为
2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+
2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+
.已知25℃时K
sp[Mg(OH)
2]=1.8×10
-11,K
sP[Cu(OH)
2]=2.2×10
-20.
(4)有人设想寻求合适的催化剂和电极材料,以N
2、H
2为电极反应物,以HCl-NH
4Cl为电解质溶液制造新型燃烧电池.请写出该电池的正极反应式
N2+6e-+8H+=2NH4+
N2+6e-+8H+=2NH4+
.
(5)某温度(t℃)时,测得0.01mol•L
-1的NaOH溶液的pH=11.在此温度下,将pH=a的H
2SO
4溶液V
aL与pH=b的NaOH溶液V
bL混合,若所得混合液为中性,且a+b=12,则V
a:V
b=
1:10
1:10
.
(6)在25℃下,将a mol•L
-1的氨水与0.01mol•L
-1的盐酸等体积混合,反应平衡时溶液中c(NH
4+)=c(Cl
-).则溶液显
中
中
性(填“酸”“碱”或“中”);用含a的代数式表示NH
3•H
2O的电离常数K
b=
.
查看答案和解析>>
科目:gzhx
来源:
题型:
(2012•中山模拟)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
向左
向左
一移动(填“向左”“向右”或“不”,下同),反应的△H
不变
不变
(填“增大…‘减小”或“不变”).使用催化剂则平衡
不
不
移动,反应的△H
不变
不变
(填“增大”、“减小”或“不变”).
(2)已知:O
2(g)═O
2+(g)+eˉ△H
1=+1175.7kJ/mol
PtF
6(g)+e-⇌PtF
6ˉ (g)△H
2=-771.1kJ/mol
O
2+PtF
6ˉ(s)═O
2+(g)+PtF
6ˉ(g)△H
3=+482.2kJ/mol
则反应O
2(g)+PtF
6(g)═O
2+PtF
6ˉ(S) 的△H=
-77.6 kJ/mol
-77.6 kJ/mol
.
(3)在25℃下,向浓度均为0.1mol/L的MgCl
2和CuCl
2混合溶液中逐滴加入氨水,生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为
2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+
2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+
.
已知25℃时K
sp[Mg(OH)
2]=1.8×10ˉ
11,K
sp[Cu(OH)
2]=2.2×10ˉ
20.
(4)7℃、1.01×10
5Pa,密闭容器中N
2O
4和NO
2的混合气体达到平衡时,c(NO
2)=0.0300mol/L、c(N
2O
4)=0.0120mol/L.计算反应2NO
2(g)⇌N
2O
4(g)的平衡常数K值为
13.3
13.3
.(保留至0.1)
查看答案和解析>>
科目:gzhx
来源:
题型:
氨在国民经济中占有重要的地位,请参与下列探究.
(1)合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g),该反应为放热反应,若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H
不改变
不改变
(填“增大”“减小”或“不改变”).
(2)已知在400℃时,N
2(g)+3H
2(g)⇌2NH
3(g)的K=0.5,则①2NH
3(g)⇌N
2(g)+3H
2(g)的K=
2
2
(填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N
2、H
2、NH
3的物质的量分别为4mol、2mol、4mol;则此时反应v(N
2)
正=
=
v(N
2)
逆(填:“>”、“<”、“=”或“不能确定”)
(3)在三个相同容器中各充入1 molN
2和3molH
2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是
D
D
(填序号).
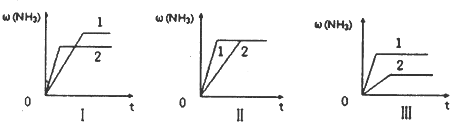
A.图Ⅰ可能是不同压强对反应的影响,且P
2>P
lB.图Ⅱ可能是不同压强对反应的影响,且P
l>P
2C.图Ⅲ可能是不同温度对反应的影响,且T
1>T
2D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
查看答案和解析>>
科目:gzhx
来源:
题型:
(2012•揭阳一模)化学与科学、技术、社会和环境密切相关.下列有关说法中错误的是( )
查看答案和解析>>
科目:gzhx
来源:
题型:
已知299K时,合成氨反应 N2(g)+3H2(g)⇌2NH3(g)△H=-92.0kJ/mol,将此温度下的1mol N2 和3mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)( )
查看答案和解析>>
科目:gzhx
来源:
题型:
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
向左
向左
移动(填“向左”、“向右”或“不”);使用催化剂
不改变
不改变
反应的△H(填“增大”“减小”或“不改变”).
(2)已知:O
2(g)═O
(g)+e
-△H
1=1175.7kJ•mol
-1PtF
6(g)+e
-═PtF
(g)△H
2=-771.1kJ•mol
-1O
2PtF
6(s)═O
(g)+PtF
(g)△H
3=482.2kJ•mol
-1则反应:O
2(g)+PtF
6(g)═O
2PtF
6(s)的△H=
-78.2
-78.2
kJ•mol
-1(3)已知25℃时,K
sp[Mg(OH)
2]=1.8×10
-11,K
sp[Cu(OH)
2]=2.2×10
-20.
在25℃下,向浓度均为0.1mol•L
-1的MgCl
2和CuCl
2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀 (填物质的化学式),生成该沉淀的离子方程式为
Cu2++2NH3•H2O⇌Cu(OH)2↓+2NH4+
Cu2++2NH3•H2O⇌Cu(OH)2↓+2NH4+
.
(4)在25℃下,将a mol•L
-1的氨水与0.01mol•L
-1的盐酸等体积混合,反应平衡时溶液中c(NH
)=c(Cl
-),则溶液显
中性
中性
性(填“酸”“碱”或“中”);用含a的代数式表示NH
3•H
2O的电离常数K
b=
.
查看答案和解析>>
科目:gzhx
来源:
题型:
(2011•枣庄模拟)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)常温下,某氨水的pH=12,则水电离的c(OH
-)=
1×10-12mol/L
1×10-12mol/L
.若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度
大于
大于
(填“大于”、“等于”或“小于”)氨水中水的电离程度.
(2)合成氨反应N
2(g)+3H
2(g)⇌2NH
3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
向左
向左
移动(填“向左”、“向右”或“不”).
(3)一定温度下,在密闭容器中可发生下列反应:2N
2O
5(g)⇌4NO
2(g)+O
2(g).下表为反应在T
1温度下的部分实验数据:
| T/s |
0 |
500 |
1000 |
| c(N2O5)/mol•L-1 |
5.00 |
3.50 |
2.42 |
则500s内N
2O
5的分解速度v(N
2O
5)=
3×10-3mol•L-1•s-1
3×10-3mol•L-1•s-1
;降温至T
2,反应进行1000s时测得c(NO
2)=4.98mol•L
-1,则反应
N
2O
5(g)⇌NO
2(g)+O
2(g)的△H
<
<
0.(填“>”、“=”、“<”).
(4)最近美国Simons等科学家发明了使NH
3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH
3.其电池反应式为:4NH
3+3O
2═2N
2+6H
2O.你认为电解质溶液应显
碱性
碱性
(填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.
查看答案和解析>>
科目:gzhx
来源:
题型:
合成氨反应N
2(g)+3H
2(g)

2NH
3(g)△H<0 具有重要的意义.
(1)该反应的化学平衡常数表达式是K=
.
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K |
473 |
573 |
673 |
… |
| K |
4.4×10-2 |
K1 |
K2 |
… |
其中,K
1>
>
K
2(填“>”、“=”或“<”).
查看答案和解析>>
科目:gzhx
来源:
题型:
下列说法中,正确的是( )
| A、对于△S>0的反应,若在任何条件下均能自发进行,则该反应△H>0 | B、氢氧燃料电池比氢气直接在空气中燃烧能量转换率高 | C、合成氨反应N2(g)+3H2(g)⇌2NH3(g);△H>0,加入催化剂能提高转化率 | D、pH=2和pH=4的两种酸混合,其混合后溶液的pH值一定在2~4之间 |
查看答案和解析>>

 合成氨反应N2(g)+3H2(g)⇌2NH3(g)△H=-94.2kJ•mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示.
合成氨反应N2(g)+3H2(g)⇌2NH3(g)△H=-94.2kJ•mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示.
 =PtF6-(g)△H2=-771.1kJ•mol-1
=PtF6-(g)△H2=-771.1kJ•mol-1 运用化学反应原理研究以下问题:
运用化学反应原理研究以下问题: 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
 2NH3(g)△H<0 具有重要的意义.
2NH3(g)△H<0 具有重要的意义.