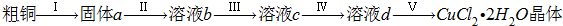为了完成祖国统一大业,党和政府制定的基本方针是什么答案解析
科目:gzhx
来源:
题型:单选题
2008年9月12日,甘肃等地陆续报告多起婴幼儿泌尿系统结石病例。现已初步查明,导致这些婴幼儿患病的主要原因是患儿服用的三鹿牌婴幼儿奶粉中含有三聚氰胺。据此回答下面几题。
1.事件发生后,国务院启动国家重大食品安全事故Ⅰ级响应,成立应急处置领导小组,国家质检总局停止实行食品类生产企业国家免检,并十数次对奶粉产品和液态奶进行三聚氰胺抽检。上述事实表明
①市场经济具有自发性、盲目性和滞后性②政府发挥着经济管理和公共服务的职能③政府工作的基本原则是对人民负责④党始终把实现好、维护好、发展好最广大人民的根本利益作为一切工作的出发点和落脚点
- A.
①③
- B.
②③
- C.
②④
- D.
③④
2.三鹿奶粉事件的发生,引起了一场奶粉行业的信任危机。一个有良知的企业,在考虑自己的商业利益之外,更应该考虑消费者的利益、公共影响和社会责任。这是因为
①商品质量与价值互为前提②商品的质量越好,生命安全越有保障③能否勇于承担社会责任,事关企业信誉和形象,关系到企业的成败④科学发展观的核心是以人为本
- A.
①②③
- B.
①②④
- C.
①③④
- D.
②③④
查看答案和解析>>
科目:gzhx
来源:高中化学新课标鲁科版必修Ⅰ 鲁科版
题型:043
研究物质性质的基本程序是什么?这个程序的每一步的完成需要进行哪些活动?每一步的目的是什么?
查看答案和解析>>
科目:gzhx
来源:高中化学新课标鲁科版必修Ⅰ 鲁科版
题型:043
划分强电解质和弱电解质的唯一标准是什么?是看其水溶液的导电能力吗?
查看答案和解析>>
科目:gzhx
来源:志鸿系列全优设计必修一化学鲁科版 鲁科版
题型:043
水溶液导电能力强的电解质一定是强电解质,水溶液导电能力弱的电解质一定是弱电解质吗?划分强电解质和弱电解质的唯一标准是什么?是看其水溶液的导电能力吗?
查看答案和解析>>
科目:gzhx
来源:设计必修一化学鲁科版 鲁科版
题型:043
水溶液导电能力强的电解质一定是强电解质,水溶液导电能力弱的电解质一定是弱电解质吗?划分强电解质和弱电解质的唯一标准是什么?是看其水溶液的导电能力吗?
查看答案和解析>>
科目:gzhx
来源:
题型:
某课外活动小组学生模拟呼吸面具中的原理用过氧化钠与潮湿二氧化碳反应,设计用下图所示的仪器来制取氧气并测量氧气的体积。
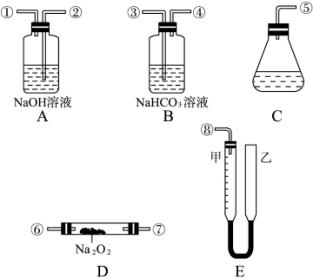
上图中量气装置中E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水,甲管有刻度(0—50 mL),供量气用;乙管可上下移动,以调节液面高低。实验可供选用的药品有:稀H2SO4、盐酸、过氧化钠、碳酸钠、大理石、水。
试完成下列问题:
(1)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略)_______。
(2)装置C中放入的反应物是_______和_______。
(3)装置A的作用是_____________________;装置B的作用是_____________________。
(4)为了较准确地测量氧气的体积,必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中应注意_______和_______(填写字母编号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中的液面不再上升时立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
查看答案和解析>>
科目:gzhx
来源:
题型:
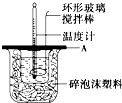
分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(1)理论上稀强酸、稀强碱反应生成1mol 水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式
.
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是
;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm
3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)
.
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验
序号 |
起始温度t1/℃ |
终止温度t2/℃ |
| 盐酸 |
氢氧化钠 |
混合溶液 |
| 1 |
20.0 |
20.1 |
23.2 |
| 2 |
20.2 |
20.4 |
23.4 |
| 3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=
.
查看答案和解析>>
科目:gzhx
来源:
题型:
请按要求完成下列各题:
(1)MgCl
2的电子式是
;丙氨酸的结构简式是
.
(2)1g C
2H
2完全燃烧生成CO
2和液态水,放出49.94kJ热量.乙炔在氧气中完全燃烧的热化学方程式是
C
2H
2(g)+
O
2(g)═2CO
2(g)+H
2O(l)△H=-1294.8kJ/mol
C
2H
2(g)+
O
2(g)═2CO
2(g)+H
2O(l)△H=-1294.8kJ/mol
.
(3)在一定条件下,分子式为C
3H
4O
2的羧酸和某醇反应生成分子式为C
5H
8O
2的酯,写出该反应的化学方程式(有机物写结构简式,下同)
CH
2=CHCOOH+CH
3CH
2OH
CH
2=CHCOOCH
2CH
3+H
2O
CH
2=CHCOOH+CH
3CH
2OH
CH
2=CHCOOCH
2CH
3+H
2O
.
(4)在一定条件下,乙烯和丙烯按1:1的物质的量比反应生成聚乙丙烯的化学方程式是
nCH
2=CH
2+nCH
2=CHCH
3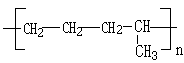
nCH
2=CH
2+nCH
2=CHCH
3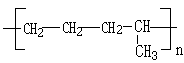
.
(5)依据酸碱质子理论,HCO
3-可以看作是
酸或碱
酸或碱
.
查看答案和解析>>
科目:gzhx
来源:
题型:

某氢氧化钾样品中含有少量不与酸作用的杂质,为了测定其质量分数,进行以下滴定操作:
A.在250ml的容量瓶中配制250ml的氢氧化钾溶液;
B.将氢氧化钾溶液装入碱式滴定管,调节液面,向锥形瓶中滴入25.00ml氢氧化钾溶液并滴入几滴甲基橙指示剂;
C.在天平上准确称取KOH样品Wg,在烧杯中用蒸馏水溶解;
D.将物质的量浓度为C mol/L的标准硫酸溶液装入酸式滴定管,调节液面记下开始读数为V
1;
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V
2.就此完成下列填空:
(1)操作步骤的正确顺序是(用编号字母填)
(2)E步骤的操作中在锥形瓶下垫一张白纸的作用是
便于准确判断终点时颜色的变化情况
便于准确判断终点时颜色的变化情况
;
(3)上述B步骤操作之前,若锥形瓶用KOH样品洗涤,则测定的浓度
偏高
偏高
(填“偏高”“偏底”或“不影响”),原因是
锥形瓶用KOH样品洗涤,锥形瓶内KOH的物质的量偏大,消耗硫酸的体积偏大
锥形瓶用KOH样品洗涤,锥形瓶内KOH的物质的量偏大,消耗硫酸的体积偏大
.
(4)D步骤的操作中液面应调节到
调节到零刻度或零稍下的某一刻度
调节到零刻度或零稍下的某一刻度
;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为
21.10
21.10
mL.
查看答案和解析>>
科目:gzhx
来源:
题型:
党的十七报告中指出:“加强能源节约和生态环境保护,增强可持续发展的动力.坚持节约资源和保护环境的基本国策,发展环保产业”.下列做法不符合这一要求的是( )
|
|
|
|
查看答案和解析>>
科目:gzhx
来源:
题型:
用2.4mol/L的H
2SO
4溶液配制100mL浓度为0.2mol/L的稀H
2SO
4,回答下列问题:
(1)需用量筒量取2.4mol/L的H
2SO
4溶液的体积是
8.3
8.3
mL
(2)配制过程有下列几步操作:
A.用10mL量筒量取所需体积的H
2SO
4溶液,注入烧杯中,用玻璃棒搅拌,使其混合均匀;
B.将蒸馏水加入容量瓶至液面接近刻度线1cm~2cm处;
C.向烧杯中加入约20mL蒸馏水;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也转移到容量瓶中;
E.用
胶头滴管
胶头滴管
加水至刻度线;
F.将烧杯中溶液冷却后,沿玻璃棒转移到
100mL容量瓶
100mL容量瓶
;
G.盖好瓶塞,反复颠倒摇匀.
完成上述步骤,且以上各步骤操作的先后顺序是
CAFDBEG
CAFDBEG
(填字母)
(3)取上述所配溶液10mL与足量BaCl
2溶液反应,生成白色沉淀0.48g.则该溶液浓度
大于
大于
0.2mol/L(填“大于”“等于”或“小于”),造成此误差的操作可能是
A
A
A.定容时俯视容量瓶; B.用量筒取2.4mol/LH
2SO
4溶液时俯视读数;C.使用容量瓶前未干燥;D.使用的烧杯和玻璃棒未洗涤彻底;E.定容时将蒸馏水洒在容量瓶外面.
查看答案和解析>>
科目:gzhx
来源:
题型:
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl
2•2H
2O).
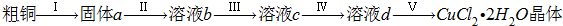
(1)为了完成步骤Ⅰ,可采用如下图所示的装置将粗铜转化为固体a.
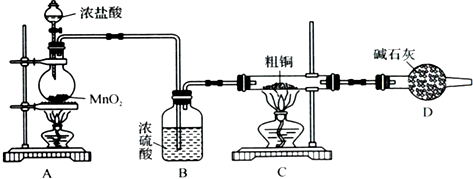
在该实验中,加热A、C装置中的酒精灯时,应该先点燃
装置的酒精灯,D装置的作用是
,C装S中生成的产物是
.
(2)步骤Ⅱ中的操作是:将步骤Ⅰ中的固体加入到容器中,然后加入
,固体完全溶解.
(3)步骤Ⅲ中加入的试剂是H
2O
2,其目的是提高最终制备的氯化铜晶体的纯度,试写出有关反应的离子方程式:
.
(4)步骤Ⅳ中应先加入某试剂,然后过滤得到滤液.为了调节溶液的pH只使Fe
3+完全沉淀,加入的试剂是CuO粉末而不用氨水或NaOH溶液,其理由是
.
(5)步骤V中,将溶液蒸发浓缩、冷却结晶、过滤得到CuCl
2•2H
2O晶体.现欲得到无水CuCl
2,在实验室也可以采用上述装置完成CuCl
2•2H
2O脱水得到无水CuCl
2,则A装置中的两种化学试剂是
.
查看答案和解析>>
科目:gzhx
来源:
题型:
分别取40mL的0 50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
环形玻璃搅拌棒
环形玻璃搅拌棒
、
量筒
量筒
.
(2)为什么中和热测定中要用稍过量的碱(或酸):
为了保证酸(或碱)能够完全被中和或通过测量值求算的是反应生成1mol水时的反应热即中和热
为了保证酸(或碱)能够完全被中和或通过测量值求算的是反应生成1mol水时的反应热即中和热
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm
3,又知中和后生成溶液的比热容c=4 18J/(g•℃).为了计算中和热,某学生实验记录数据如下:

依据该学生的实验数据计算,该实验测得的中和热△H=
-50.2KJ/mol
-50.2KJ/mol
; (结果保留一位小数)
(4)上述实验数值结果与中和热的理论值57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
abd
abd
.
a.实验装置保温、隔热效果差 b.量取盐酸与氢氧化钠溶液时仰视读数c.分多次把Na0H溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度.
查看答案和解析>>
科目:gzhx
来源:
题型:
(2012•汕头一模)某同学利用铁与水蒸气反应后的固体物质进行了如下实验:

(1)固体溶于盐酸的化学方程式为
Fe3O4+8HC1=2FeC13+FeC12+4H2O
Fe3O4+8HC1=2FeC13+FeC12+4H2O
;
(2)试剂1的化学式是
KSCN
KSCN
;加入试剂1后呈红色的原因是(用离子方程式表示):
Fe3++3SCN-⇌Fe(SCN)3
Fe3++3SCN-⇌Fe(SCN)3
.
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示):
2Fe2++C12=2Fe3++2C1-
2Fe2++C12=2Fe3++2C1-
.
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?
| 编号 |
猜想 |
| 甲 |
溶液中的+3价Fe又被还原为+2价Fe |
| 乙 |
溶液中的SCN-被过量的氯水氧化 |
| 丙 |
新制的氯水具有漂白性,将该溶液漂白 |
| 丁 |
溶液中Fe3+被氧化为更高的价态 溶液中Fe3+被氧化为更高的价态 |
为验证乙同学的猜想是合理的,请你根据此结论完成下表的实验设计方案.可选用试剂:浓硫酸、1.0mol•L
-1HNO
3、1.0mol•L
-1盐酸、1.0mol•L
-1NaOH溶液、0.1mol•L
-1FeCl
3溶液、0.1mol•L
-1CuSO
4溶液、20%KSCN溶液、蒸馏水.
| 实验操作 |
预期现象 |
结论 |
取少量褪色后的溶液于试管中,逐滴加入20%KSCN溶液 取少量褪色后的溶液于试管中,逐滴加入20%KSCN溶液 |
溶液变红色 溶液变红色 |
说明乙同学的猜想是合理的 |
查看答案和解析>>
科目:gzhx
来源:
题型:阅读理解
(1)Xe和F
2在一定条件下发生反应,Xe+F
2⇌XeF
2;XeF
2+F
2⇌XeF
4;XeF
4+F
2⇌XeF
6;可得XeF
2、XeF
4、XeF
6三种气态氟化物.当压强一定,温度升高时,三种氟化物在平衡混合物中的浓度均减小.当压强为700kPa、温度达到1250℃时,测得XeF
2的体积分数约为95%.那么,为了有效地制备XeF
2,你认为应该采取的合适措施是
.
(2)据报道,在-55℃,将XeF
4(X)和C
6F
5BF
2(Y)化合,可得一离子化合物(Z),测得Z中Xe的质量分数为31%,阴离子为四氟硼酸根离子,阳离子结构中含有Y的苯环,Z是首例有机氙(Ⅳ)的化合物,-20℃以下稳定.Z为强氧化剂,如与碘反应得到五氟化碘,放出氙,同时得到Y.据此回答(要求化合物Z以离子形式表示):
①写出合成Z反应的化学方程式
.
②写出Z和碘反应的化学方程式
.
(3)英国化学家以巴特莱特将等物质的量的PtF
6与Xe混合在室温下反应,制得第一个稀有气体化合物六氟合铂酸氙:Xe﹢PtF
6﹦XePtF
6.该化合物极易与水反应,生成氙、氧气和铂的+4价氧化物等.已知生成物氙和氧气的物质的量之比为2﹕1.试写出XePtF
6水解反应的化学方程式
.
(4)现将二份等质量的XeF
2和XeF
4的混合物进行如下实验:
①一份用水处理,得到气体A和溶液B,A的体积为67.7mL(标准状况,下同),其中含O
222.7mL,其余为Xe.B中的XeO
3能氧化30.00mL浓度为0.1000mol∕L的(NH
4)
2Fe(SO
4)
2.(XeO
3被还原为Xe)
②另一份用KI溶液处理,生成的I
2用0.2000mol∕L的Na
2S
2O
3溶液滴定,共用去35.00mL.
已知反应 I
2+2S
2O
32-═S
4O
62-+2I
-,试求混合物中XeF
2和XeF
4的物质的量.
.
查看答案和解析>>
科目:gzhx
来源:2011届福建省厦门市双十中学高三上学期期中考试化学试卷
题型:填空题
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
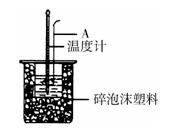
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3 kJ/(g·℃)。为了计算中和热,某学生实验记录数据如下:
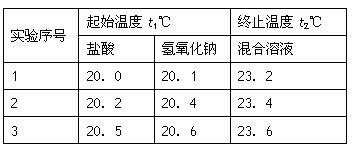

依据该学生的实验数据计算,该实验测得的中和热△H=___________;(结果保留一位小数)
(4)若用0.50mol/L醋酸代替盐酸和氢氧化钠溶液反应则测得中和热会 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:gzhx
来源:2011-2012学年湖南浏阳一中高一下学期第三次阶段性考试化学试卷
题型:实验题
(10分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。

请回答该实验中的问题。
(1)写出该反应的化学方程式 。
(2)实验前必须对整套装置进行的操作是 。
(3)硬质玻璃管中石棉绒的主要作用是 。
(4)干燥管中盛装的物质可以是
(5)点燃酒精灯和酒精喷灯的先后顺序是
查看答案和解析>>
科目:gzhx
来源:
题型:
分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3 kJ/(g·℃)。为了计算中和热,某学生实验记录数据如下:
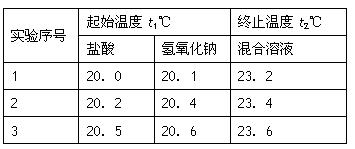
依据该学生的实验数据计算,该实验测得的中和热△H=___________;(结果保留一位小数)
(4)若用0.50mol/L醋酸代替盐酸和氢氧化钠溶液反应则测得中和热会 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:gzhx
来源:
题型:
当前城市空气质量恶劣的重要原因是汽车尾气的超标排放,你能否应用氮元素单质和化合物之间的转化关系,设计除去汽车尾气中的CO和氮氧化物(如NO、NO2等)的理论构想?其中包括:确定无害化过程及其产物和选择无害化试剂及反应条件等。
(1)将有害物质转化为什么物质即可完成无害化过程?
(2)应依据什么化学原理完成无害化过程?
(3)完成无害化过程中,无害化试剂的选择原则是什么?
(4)对无害化过程反应条件的确定原则是什么?
(5)写出无害化过程的化学方程式。
查看答案和解析>>
科目:gzhx
来源:2012届江苏省高三化学期中化学试卷
题型:填空题
(14分)某同学利用铁与水蒸气反应后的固体物质进行了如下实验:

(1)固体溶于稀盐酸的化学方程式为 ▲
;
(2)试剂1的化学式是 ▲
;加入试剂1后呈红色的原因是(用离子方程式表示): ▲
。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示) ▲
;
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?
|
编 号
|
猜
想
|
|
甲
|
溶液中的+3价Fe又被还原为+2价Fe
|
|
乙
|
溶液中的SCN-被过量的氯水氧化
|
|
丙
|
新制的氯水具有漂白性,将该溶液漂白
|
|
丁
|
?
|
为验证乙同学的猜想合理与否?请同学们根据结论完成下表的实验设计方案。可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0 mol·L-1
NaOH、0.1mol·L-1FeCl3、0.1mol·L-1CuSO4、20%KSCN、蒸馏水。
|
实验操作
|
预期现象
|
结 论
|
|
|
|
说明乙同学的猜想是合理的
|
查看答案和解析>>


 分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.

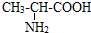
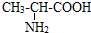
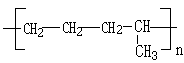
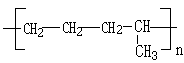
 某氢氧化钾样品中含有少量不与酸作用的杂质,为了测定其质量分数,进行以下滴定操作:
某氢氧化钾样品中含有少量不与酸作用的杂质,为了测定其质量分数,进行以下滴定操作: