
科目:gzhx 来源:云南省同步题 题型:单选题
科目:gzhx 来源:2013届浙江省绍兴市高二下学期期末考试化学试卷(解析版) 题型:选择题
某苛性钾样品中含有不与酸反应的杂质,为了测定苛性钾的纯度,取样品0.56g溶于水制成1L溶液。取此溶液25.00mL,用0.005mol/LH2SO4标准液滴定,用去24mL标准液。则苛性钾的纯度为
A. 96% B. 48% C. 9.6% D. 56%
科目:gzhx 来源: 题型:
某苛性钾样品中含有不与酸反应的杂质,为了测定苛性钾的纯度,取样品0.56g溶于水制成1L溶液。取此溶液25.00mL,用0.005mol/LH2SO4标准液滴定,用去24mL标准液。则苛性钾的纯度为
A. 96% B. 48% C. 9.6% D. 56%
科目:gzhx 来源:2011-2012学年浙江省绍兴市鲁迅中学高二下学期期末考试化学试卷(带解析) 题型:单选题
某苛性钾样品中含有不与酸反应的杂质,为了测定苛性钾的纯度,取样品0.56g溶于水制成1L溶液。取此溶液25.00mL,用0.005mol/LH2SO4标准液滴定,用去24mL标准液。则苛性钾的纯度为
| A.96% | B.48% | C.9.6% | D.56% |
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:
为测定苛性钾的纯度,取样品![]() 溶于水配制成1 L溶液,取此溶液
溶于水配制成1 L溶液,取此溶液![]() ,用去
,用去![]() 溶液
溶液![]() ,恰好反应完全,则苛性钾的纯度为(杂质不与酸反应)
,恰好反应完全,则苛性钾的纯度为(杂质不与酸反应)
A. 96% B. 48% C. 9.6% D. 56%
科目:gzhx 来源: 题型:
A.96% B.48% C.9.6% D.56%
科目:gzhx 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:013
为测定苛性钾的纯度,取0.56g样品溶于水制成1L溶液.取此溶液25.00mL,用去0.005mol·L-1 H2SO4溶液24.00mL,二者恰好完全反应,设苛性钾中杂质都不与酸反应,则苛性钾的纯度为
[ ]
科目:gzhx 来源: 题型:013
为测定KOH的纯度,取样品0.56g,溶于水制成1L溶液,取该溶液25mL,用0.005mol/L![]() 标准溶液去滴定,终点恰好为24mL,则KOH的纯度为(杂质不与酸反应)
标准溶液去滴定,终点恰好为24mL,则KOH的纯度为(杂质不与酸反应)
[ ]
A.96% B.56% C.48% D.90%
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
(1)聚苯乙烯材料会造成“白色污染”,是因为____________________________________。
(2)乳酸是以淀粉为原料水解成葡萄糖,再经乳酸菌发酵制得:
C6H12O6![]() 2C3H6O3。为测定乳酸的分子结构,取9.0 g乳酸进行如下实验:
2C3H6O3。为测定乳酸的分子结构,取9.0 g乳酸进行如下实验:
①跟NaOH反应,消耗了1.0 mol·L-1的NaOH溶液100 mL,由此说明________________。
②跟足量的金属钠反应,放出气体2 240 mL(标准状况下)。由此说明___________________。
③以银为催化剂跟O2反应,生成CH3COCOOH。由此说明___________________________。
(3)试写出两个乳酸分子反应生成C6H8O4的化学方程式(有机物用结构简式表示)________________。
科目:gzhx 来源: 题型:阅读理解
| 温度℃ 溶解度 溶质 g/100g水 |
10 | 20 | 30 | 40 | 50 | 60 | 70 |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | ||||
| NaHCO3 | 8.2 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 | |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
| c×V1 ×10-3×M(Na2CO3)g |
| Gg |
科目:gzhx 来源: 题型:
| △ |
科目:gzhx 来源: 题型:
 新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N
新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N
| ||
科目:gzhx 来源:2012-2013学年上海市四区(杨浦、青浦、宝山、静安)高三下学期二模化学试卷(解析版) 题型:实验题
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。
|
溶解度 溶质 g/100g水 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
|
NH4HCO3 |
15.8 |
21.0 |
27.0 |
|
|
|
|
|
NaHCO3 |
8.2 |
9.6 |
11.1 |
12.7 |
14.4 |
16.4 |
|
|
NH4Cl |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
60.2 |
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置, a 、 b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是 。
(2)“转化”的离子方程式是 。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是 ;为什么温度控制在30~35℃之间? 。
(4)a、b处的操作分别是 、 。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1 mL。此时发生的反应为:CO32- + H+ →HCO3-
①样品中碳酸钠质量百分含量的表达式是 。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是 ;根据实验数据,如何判断样品含有NaHCO3 。
科目:gzhx 来源:广东省惠州市2010-2011学年高三第一次调研考试(理综)化学部分 题型:实验题
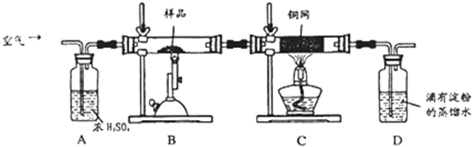
(16分)某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应:
6CuFeS2+19O2 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;
(1)称量该样品时用的仪器的名称为 。
(2)装置A的作用 ;
a.有利于空气中氧气充分反应 b.除去空气中的水份
c.有利于气体混合 d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的 。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
科目:gzhx 来源:2015届广东省高一上期末考试化学试卷(解析版) 题型:实验题
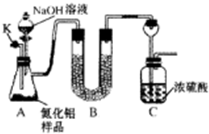
过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1)根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母): 。
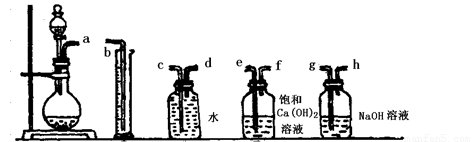
① ② ③ ④ ⑤
(2)装置④的作用是 。
(3)如果实验时,称取w g样品和过量盐酸反应后,测得氧气的体积(标准状况)为V mL,则此样品的纯度为 。
科目:gzhx 来源: 题型:
为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?________________;理由是_______________________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1 C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:________________________________。
科目:gzhx 来源:黑龙江省2009-2010学年度上学期高三期末(化学)试题 题型:实验题
(12分)为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?________________;理由是_______________________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1 C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:________________________________。
科目:gzhx 来源: 题型:
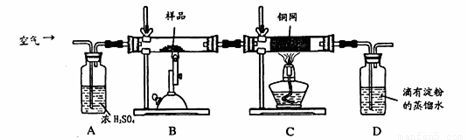
(16分)某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应:
6CuFeS2+19O26CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;
(1)称量该样品时用的仪器的名称为 。
(2)装置A的作用 ;
a.有利于空气中氧气充分反应 b.除去空气中的水份
c.有利于气体混合 d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的 。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)