
科目:gzhx 来源:同步题 题型:单选题

科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
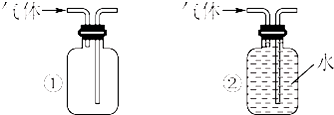
科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:阅读理解
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |



| 实验步骤 | 实验现象 |
| 1.将一小块④的单质放入滴有酚酞溶液的冷水中 | 钠浮在水面上,熔成小球,四处游动 钠浮在水面上,熔成小球,四处游动 ,发出嘶嘶响声,逐渐消失,溶液变成红色 |
| 2.将少量冷水注入盛有打磨过的⑤的单质的试管中,再滴加酚酞,一段时间后加热至沸腾 | 加热后 镁条表面产生无色气泡,溶液呈红色 镁条表面产生无色气泡,溶液呈红色 |
| 3.将2mL 1mol/L盐酸加入盛有打磨过的⑤的单质的试管中 | 剧烈反应,迅速产生大量无色气泡 |
| 4.将2mL 1mol/L盐酸加入盛有打磨过的 Al Al 的单质的试管中 |
反应缓慢,一段时间后,产生无色气泡 |
| 结论: Na、Mg、Al三种元素的金属性依次减弱 Na、Mg、Al三种元素的金属性依次减弱 (用元素符号结合文字说明) | |
科目:gzhx 来源: 题型:阅读理解
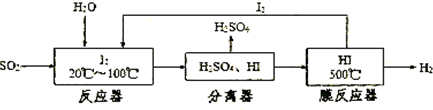
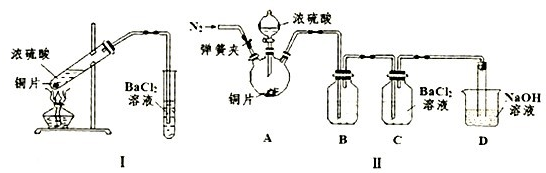
科目:gzhx 来源: 题型:
 某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:

科目:gzhx 来源: 题型:
2- 3 |
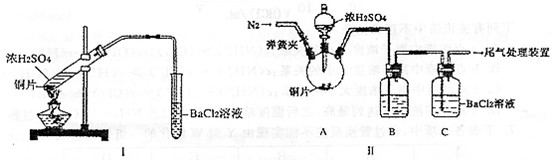
科目:gzhx 来源:2012-2013学年甘肃省兰州一中高二上学期期末考试化学试卷(带解析) 题型:填空题
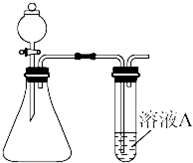
(10分)某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu + H2SO4(稀) = CuSO4 + H2↑
(1)请在右边方框中画出能够实现这一反应的装置图。
(2)在设计实验实际操作时,由于装置连接不当,他看到了完全不同的实验现象:碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色。请你分析其原因 ① 。
假设按照该方案进行实验,且收集到碳棒上产生气体体积为11. 2L(标准状况下)。则该过程中铜片上发生的反应式为 ② 。此时要使溶液恢复到实验前的状态,需加入 ③ (写出该物质的化学式),其质量为 ④ 。
科目:gzhx 来源:2014届甘肃省高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu + H2SO4(稀) = CuSO4 + H2↑
(1)请在右边方框中画出能够实现这一反应的装置图。

(2)在设计实验实际操作时,由于装置连接不当,他看到了完全不同的实验现象:碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色。请你分析其原因 ① 。
假设按照该方案进行实验,且收集到碳棒上产生气体体积为11. 2L(标准状况下)。则该过程中铜片上发生的反应式为 ② 。此时要使溶液恢复到实验前的状态,需加入 ③ (写出该物质的化学式),其质量为 ④ 。
科目:gzhx 来源:2010-2011学年河南省信阳市高三第二次调研考试化学试卷 题型:实验题
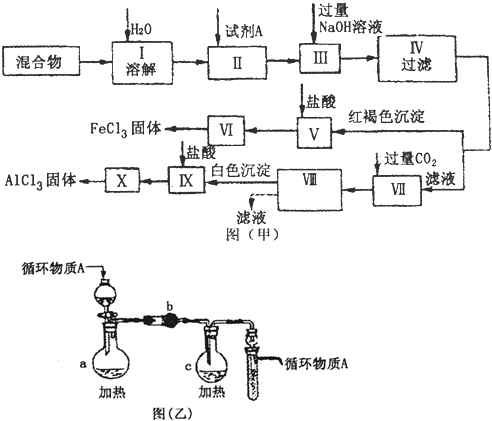
(12分)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3,某同学设计并进行实验对该混合物进行分离,以得到纯净的AlCl3和FeCl3,图甲是该同学设计并进行的实验:

(1)实验操作Ⅱ需加入适宜的试剂,你认为最好选用的试剂是___________。
A.KMnO4(H+)溶液 B.硝酸 C.H2O2 D.浓硫酸
(2)操作V的离子方程式为_______________________________________________;
操作Ⅶ的离子方程式为________________________________________________。
(3)图乙是操作Ⅵ、X制取无水FeCl3、AlCl3的部分装置(铁架台、加热装置等已略去)。

①图乙中,装置a由____________、圆底烧瓶、双孔塞和导管组成。
②循环物质A是______________________。
③装置b中填充的物质可以是_______________________(填编号)。
A.碱石灰 B.无水氯化钙 C.浓硫酸 D.五氧化二磷
(4)你认为该同学的实验最后_____________(填“能”或“不能”)得到纯净的AlCl3和FeCl3。若不能,请你完善该同学的实验步骤设计(用文字叙述):________________
_____________________________________________。(若能,此空不填)
科目:gzhx 来源:专项题 题型:实验题


科目:gzhx 来源:2008-2009学年北京市西城区高一(下)期末化学试卷(解析版) 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 实验步骤 | 实验现象 |
| 1.将一小块④的单质放入滴有酚酞溶液的冷水中 | ______,发出嘶嘶响声,逐渐消失,溶液变成红色 |
| 2.将少量冷水注入盛有打磨过的⑤的单质的试管中,再滴加酚酞,一段时间后加热至沸腾 | 加热后______ |
| 3.将2mL 1mol/L盐酸加入盛有打磨过的⑤的单质的试管中 | 剧烈反应,迅速产生大量无色气泡 |
| 4.将2mL 1mol/L盐酸加入盛有打磨过的______的单质的试管中 | 反应缓慢,一段时间后,产生无色气泡 |
| 结论:______(用元素符号结合文字说明) | |
科目:gzhx 来源:2012-2013学年甘肃省兰州一中高二(上)期末化学试卷(解析版) 题型:解答题

科目:gzhx 来源:2008-2009学年北京市西城区高一(下)期末化学试卷(解析版) 题型:解答题
科目:gzhx 来源: 题型:
(12分)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3,某同学设计并进行实验对该混合物进行分离,以得到纯净的AlCl3和FeCl3,图甲是该同学设计并进行的实验:
(1)实验操作Ⅱ需加入适宜的试剂,你认为最好选用的试剂是___________。
A.KMnO4(H+)溶液 B.硝酸 C.H2O2 D.浓硫酸
(2)操作V的离子方程式为_______________________________________________;
操作Ⅶ的离子方程式为________________________________________________。
(3)图乙是操作Ⅵ、X制取无水FeCl3、AlCl3的部分装置(铁架台、加热装置等已略去)。
①图乙中,装置a由____________、圆底烧瓶、双孔塞和导管组成。
②循环物质A是______________________。
③装置b中填充的物质可以是_______________________(填编号)。
A.碱石灰 B.无水氯化钙 C.浓硫酸 D.五氧化二磷
(4)你认为该同学的实验最后_____________(填“能”或“不能”)得到纯净的AlCl3和FeCl3。若不能,请你完善该同学的实验步骤设计(用文字叙述):________________
_____________________________________________。(若能,此空不填)
科目:gzhx 来源:2011届河南省信阳市高三第二次调研考试化学试卷 题型:实验题
(12分)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3,某同学设计并进行实验对该混合物进行分离,以得到纯净的AlCl3和FeCl3,图甲是该同学设计并进行的实验: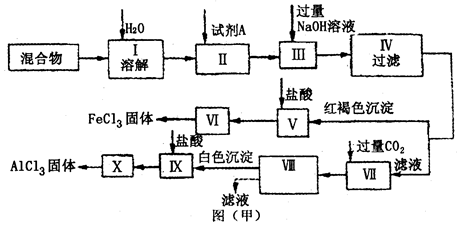
(1)实验操作Ⅱ需加入适宜的试剂,你认为最好选用的试剂是___________。
A.KMnO4(H+)溶液 B.硝酸 C.H2O2 D.浓硫酸
(2)操作V的离子方程式为_______________________________________________;
操作Ⅶ的离子方程式为________________________________________________。
(3)图乙是操作Ⅵ、X制取无水FeCl3、AlCl3的部分装置(铁架台、加热装置等已略去)。
①图乙中,装置a由____________、圆底烧瓶、双孔塞和导管组成。
②循环物质A是______________________。
③装置b中填充的物质可以是_______________________(填编号)。
A.碱石灰 B.无水氯化钙 C.浓硫酸 D.五氧化二磷
(4)你认为该同学的实验最后_____________(填“能”或“不能”)得到纯净的AlCl3和FeCl3。若不能,请你完善该同学的实验步骤设计(用文字叙述):________________
_____________________________________________。(若能,此空不填)
科目:gzhx 来源: 题型:

| 装置 | 现象 | 结论 |
| A | 无明显现象 无明显现象 |
潮湿的氯气 能 能 (填能或不能)使红色纸条褪色,因为反应生成的HClO HClO 具有漂白性 |
| B | 纸条褪色 纸条褪色 |
科目:gzhx 来源:2011-2012学年高考化学一轮复习《烃的衍生物》专题综合测试(苏教版) 题型:实验题
(8分)某同学用如图所示装置制取溴苯和溴乙烷。已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-119℃,密度为1.46 g·cm-3。
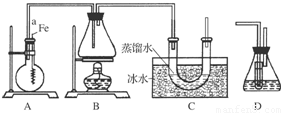
主要实验步骤如下:
①检查装置的气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处。
③将A装置中的纯铁丝小心向下插入混合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10 min。
请填写下列空白:
(1)步骤③中观察到的现象是_____________________________________________。
(2)导管a的作用是_______________________________________________________。
(3)C装置中U形管内部用蒸馏水封住管底的作用是
_______________________________________________________________________________________________________________________________________________。
(4)反应完毕后,U形管内的现象是____________________________________________;
分离溴乙烷时所用的最主要仪器的名称是(只填一种)____________________________。
(5)步骤④中能否用大火加热,理由是___________________________________。
(6)为证明溴和苯的上述反应是取代反应而不是加成反应,该同学用装置D代替装置B、C直接与A相连重新操作实验。
①装置D的锥形瓶中,小试管内的液体是________(填名称),其作用是________________;小试管外的液体是________(填名称),其作用是_________________。
②反应后,向锥形瓶中滴加________溶液,现象是__________________,其作用是____________________;装置D还可起到的作用是__________________________________。
科目:gzhx 来源: 题型:
(8分)某同学用如图所示装置制取溴苯和溴乙烷。已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-119℃,密度为1.46 g·cm-3。
主要实验步骤如下:
①检查装置的气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处。
③将A装置中的纯铁丝小心向下插入混合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10 min。
请填写下列空白:
(1)步骤③中观察到的现象是_____________________________________________。
(2)导管a的作用是_______________________________________________________。
(3)C装置中U形管内部用蒸馏水封住管底的作用是
_______________________________________________________________________________________________________________________________________________。
(4)反应完毕后,U形管内的现象是____________________________________________;
分离溴乙烷时所用的最主要仪器的名称是(只填一种)____________________________。
(5)步骤④中能否用大火加热,理由是___________________________________。
(6)为证明溴和苯的上述反应是取代反应而不是加成反应,该同学用装置D代替装置B、C直接与A相连重新操作实验。
①装置D的锥形瓶中,小试管内的液体是________(填名称),其作用是________________;小试管外的液体是________(填名称),其作用是_________________。
②反应后,向锥形瓶中滴加________溶液,现象是__________________,其作用是____________________;装置D还可起到的作用是__________________________________。