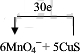
科目:gzhx
来源:
题型:
在稀硫酸中,KMnO
4和H
2O
2能发生氧化还原反应:
氧化反应:H
2O
2-2e
-═2H
++O
2↑
还原反应:
Mn+5e
-+8H
+═Mn
2++4H
2O
(1)写出该氧化还原反应的离子方程式:
5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
.
(2)该反应中氧化剂是
KMnO4
KMnO4
,被氧化的元素是
氧
氧
;若有0.5mol H
2O
2参加此反应,则转移电子个数为
6.02×1023
6.02×1023
.
(3)若KMnO
4的量不足,在Mn
2+的催化作用下,H
2O
2仍能分解,分解反应的化学方程式为
;这时若有0.5mol H
2O
2发生分解,则转移电子个数为
3.01×1023
3.01×1023
.
查看答案和解析>>
科目:gzhx
来源:2013届陕西省澄城县寺前中学高三第一次月考化学试卷(带解析)
题型:填空题
(12分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2 – 2e- = 2H+ + O2↑ 还原反应:MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式: 。
(2)反应中氧化剂是 ;氧化产物是 ;若有0.5molH2O2参加此反应,电子一转移个数为 。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为 ;这时若有0.5molH2O2发生分解,电子转移个数为 。
查看答案和解析>>
科目:gzhx
来源:2013届江苏省兴化市板桥高级中学高三9月双休检测化学试卷(带解析)
题型:填空题
(14分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:______________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为__________________;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
查看答案和解析>>
科目:gzhx
来源:2012-2013学年陕西省高三第一次月考化学试卷(解析版)
题型:填空题
(12分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2 – 2e-
= 2H+ + O2↑ 还原反应:MnO4- +
5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式:
。
(2)反应中氧化剂是 ;氧化产物是 ;若有0.5molH2O2参加此反应,电子一转移个数为
。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为
;这时若有0.5molH2O2发生分解,电子转移个数为
。
查看答案和解析>>
科目:gzhx
来源:2013届江苏省兴化市板桥高级中学高三9月双休检测化学试卷(带解析)
题型:填空题
(14分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:______________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为__________________;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
查看答案和解析>>
科目:gzhx
来源:2012-2013学年江苏省兴化市高三9月双休检测化学试卷(解析版)
题型:填空题
(14分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:______________________________________。
(2)该反应中氧化剂是________,被氧化的元素是________;若有0.5 mol H2O2参加此反应,则转移电子个数为________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为__________________;这时若有0.5 mol H2O2发生分解,则转移电子个数为________。
查看答案和解析>>
科目:gzhx
来源:内蒙古包头三十三中2012届高三上学期期中考试化学试题
题型:022
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e- 2H++O2↑
2H++O2↑
还原反应:MnO4-+5e-+8H+ Mn2++4H2O
Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:________.
(2)若有0.5 mol H2O2参加此反应,电子转移的物质的量为________;若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:________;这时若有1 mol H2O2发生分解,电子转移个数为________.
查看答案和解析>>
科目:gzhx
来源:不详
题型:问答题
在稀硫酸中,KMnO
4和H
2O
2能发生氧化还原反应:
氧化反应:H
2O
2-2e
-═2H
++O
2↑
还原反应:
Mn+5e
-+8H
+═Mn
2++4H
2O
(1)写出该氧化还原反应的离子方程式:______.
(2)该反应中氧化剂是______,被氧化的元素是______;若有0.5mol H
2O
2参加此反应,则转移电子个数为______.
(3)若KMnO
4的量不足,在Mn
2+的催化作用下,H
2O
2仍能分解,分解反应的化学方程式为______;这时若有0.5mol H
2O
2发生分解,则转移电子个数为______.
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-═2H++O2↑
还原反应: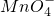 +5e-+8H+═Mn2++4H2O
+5e-+8H+═Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:______.
(2)该反应中氧化剂是______,被氧化的元素是______;若有0.5mol H2O2参加此反应,则转移电子个数为______.
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为______;这时若有0.5mol H2O2发生分解,则转移电子个数为______.
查看答案和解析>>
科目:gzhx
来源:2012-2013学年江苏省泰州市兴化市板桥高级中学高三(上)双休检测化学试卷(9月份)(解析版)
题型:解答题
在稀硫酸中,KMnO
4和H
2O
2能发生氧化还原反应:
氧化反应:H
2O
2-2e
-═2H
++O
2↑
还原反应:

+5e
-+8H
+═Mn
2++4H
2O
(1)写出该氧化还原反应的离子方程式:______.
(2)该反应中氧化剂是______,被氧化的元素是______;若有0.5mol H
2O
2参加此反应,则转移电子个数为______.
(3)若KMnO
4的量不足,在Mn
2+的催化作用下,H
2O
2仍能分解,分解反应的化学方程式为______ 2H
2O+O
2↑
查看答案和解析>>
科目:gzhx
来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应
题型:022
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应生成MnSO4、K2SO4、H2O和O2
(1)写出该氧化还原反应的化学方程式:________.
(2)反应中氧化剂是________;被氧化的元素是________;若有0.5 mol H2O2参加此反应,电子转移个数为________.
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:________;这时若有0.5 mol H2O2发生分解,电子转移个数为________.
查看答案和解析>>
科目:gzhx
来源:内蒙古包头三十三中2012届高三上学期期中考试化学试题
题型:022
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e- 2H++O2↑
2H++O2↑
还原反应:MnO4-+5e-+8H+ Mn2++4H2O
Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:________.
(2)若有0.5 mol H2O2参加此反应,电子转移的物质的量为________;若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:________;这时若有1 mol H2O2发生分解,电子转移个数为________.
查看答案和解析>>
科目:gzhx
来源:
题型:
(2009•静安区一模)已知在稀硫酸中,KBrO
3和KI能发生以下反应(均未配平):
BrO
3-+H
++I
-→I0
3-+Br
2+H
20 I0
3-+H
++Br
-→Br
2+I
2+H
20
(1)试比较在酸性条件下BrO
3-、Br
2、I0
3-、I
2氧化性的强弱:
BrO3-
BrO3-
>
I03-
I03-
>
Br2
Br2
>
I2
I2
.
(2)配平下列反应的离子方程式:
1
1
BrO
3-+
6
6
H
++
6
6
I
-→
3
3
I
2+
1
1
Br
-+
3
3
H
20
反应中的氧化剂是
BrO3-
BrO3-
;被氧化的元素是
I-
I-
.
(3)在稀硫酸中,若KI和KBrO
3按物质的量之比6:1.1反应,生成的产物是H
20、
Br2
Br2
、
I2
I2
、
Br-
Br-
(用化学式或离子符号表示).
查看答案和解析>>
科目:gzhx
来源:静安区一模
题型:问答题
已知在稀硫酸中,KBrO3和KI能发生以下反应(均未配平):
BrO3-+H++I-→I03-+Br2+H20 I03-+H++Br-→Br2+I2+H20
(1)试比较在酸性条件下BrO3-、Br2、I03-、I2氧化性的强弱:______>______>______>______.
(2)配平下列反应的离子方程式:
______BrO3-+______H++______I-→______I2+______Br-+______H20
反应中的氧化剂是______;被氧化的元素是______.
(3)在稀硫酸中,若KI和KBrO3按物质的量之比6:1.1反应,生成的产物是H20、______、______、
______ (用化学式或离子符号表示).
查看答案和解析>>
科目:gzhx
来源:2009年上海市静安区高考化学一模试卷(解析版)
题型:解答题
已知在稀硫酸中,KBrO3和KI能发生以下反应(均未配平):
BrO3-+H++I-→I03-+Br2+H20 I03-+H++Br-→Br2+I2+H2
(1)试比较在酸性条件下BrO3-、Br2、I03-、I2氧化性的强弱:______>______>______>______.
(2)配平下列反应的离子方程式:
______BrO3-+______H++______I-→______I2+______Br-+______H2
反应中的氧化剂是______;被氧化的元素是______.
(3)在稀硫酸中,若KI和KBrO3按物质的量之比6:1.1反应,生成的产物是H20、______、______、
______ (用化学式或离子符号表示).
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
已知在稀硫酸中,KBrO3和KI能发生以下反应(均未配平):
BrO3-+H++I-→I03-+Br2+H20 I03-+H++Br-→Br2+I2+H20
(1)试比较在酸性条件下BrO3-、Br2、I03-、I2氧化性的强弱:______>______>______>______.
(2)配平下列反应的离子方程式:
______BrO3-+______H++______I-→______I2+______Br-+______H20
反应中的氧化剂是______;被氧化的元素是______.
(3)在稀硫酸中,若KI和KBrO3按物质的量之比6:1.1反应,生成的产物是H20、______、______、
______ (用化学式或离子符号表示).
查看答案和解析>>
科目:gzhx
来源:
题型:
(2013•上海二模)高锰酸钾是一种典型的强氧化剂.
(1)在用KMnO
4酸性溶液处理Cu
2S和CuS的混合物时,发生的反应如下:
①MnO
4-+Cu
2S+H
+→Cu
2++SO
2↑+Mn
2++H
2O(未配平)
②MnO
4-+CuS+H
+→Cu
2++SO
2↑+Mn
2++H
2O(未配平)
(2)下列关于反应①的说法中错误的是
d
d
(选填编号).
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下) SO
2,转移电子的物质的量是0.8mol
d.还原性的强弱关系是:Mn
2+>Cu
2S
(3)标出反应②中电子转移的方向和数目:MnO
4-+CuS
(4)在稀硫酸中,MnO
4-和H
2O
2也能发生氧化还原反应
氧化反应:H
2O
2-2e→2H
++O
2↑
还原反应:MnO
4-+5e+8H
+→Mn
2++4H
2O
(5)反应中若有0.5mol H
2O
2参加此反应,转移电子的个数为
NA
NA
.由上述反应得出的物质氧化性强弱的结论是
MnO4-
MnO4-
>
H2O2
H2O2
(填写化学式).
(6)已知:2KMnO
4+7H
2O
2+3H
2SO
4→K
2SO
4+2MnSO
4+6O
2↑+10H
2O,则被1mol KMnO
4氧化的H
2O
2是
2.5
2.5
mol.
查看答案和解析>>
科目:gzhx
来源:
题型:
高锰酸钾是一种典型的强氧化剂.
(1)在用KMnO
4酸性溶液处理Cu
2S和CuS的混合物时,发生的反应如下:
Ⅰ.MnO
4-+Cu
2S+H
+→Cu
2++SO
2↑+Mn
2++H
2O(未配平)
Ⅱ.MnO
4-+CuS+H
+→Cu
2++SO
2↑+Mn
2++H
2O(未配平)
请回答下列问题:
①下列关于反应Ⅰ的说法不正确的是
BE
BE
.
A.被氧化的元素是Cu和S
B.MnO
4-是氧化剂,Cu
2S既是氧化剂又是还原剂
C.氧化剂与还原剂的物质的量之比为8:5
D.生成2.24L(标况下) SO
2,转移电子的物质的量是0.8mol
E.氧化性的强弱关系是:MnO
4->Mn
2+>Cu
2+②用单线桥表示反应Ⅱ中电子转移的数目和方向:MnO
4-+CuS
(2)①在稀硫酸中,MnO
4-和H
2O
2也能发生氧化还原反应:
氧化反应:H
2O
2-2e
-═2H
++O
2↑
还原反应:MnO
4-+5e
-+8H
+═Mn
2++4H
2O
写出该氧化还原反应的化学方程式:
5H2O2+2KMnO4+3H2SO4═2MnSO4+5O2↑+K2SO4+8H2O
5H2O2+2KMnO4+3H2SO4═2MnSO4+5O2↑+K2SO4+8H2O
.
反应中若有0.5mol H
2O
2参加此反应,转移电子的个数为
NA
NA
.由上述反应得出的氧化性强弱的结论是
KMnO4>O2
KMnO4>O2
.
②实验中发现,当加入的少量KMnO
4完全反应后,H
2O
2仍能发生反应放出气体.其可能的原因是:
还原产物Mn2+催化H2O2分解生成氧气
还原产物Mn2+催化H2O2分解生成氧气
.
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
高锰酸钾是一种典型的强氧化剂.
(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO4-+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO4-+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
(2)下列关于反应①的说法中错误的是______(选填编号).
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24L(标况下) SO2,转移电子的物质的量是0.8mol
d.还原性的强弱关系是:Mn2+>Cu2S
(3)标出反应②中电子转移的方向和数目:MnO4-+CuS______
(4)在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e→2H++O2↑
还原反应:MnO4-+5e+8H+→Mn2++4H2O
(5)反应中若有0.5mol H2O2参加此反应,转移电子的个数为______.由上述反应得出的物质氧化性强弱的结论是______>______(填写化学式).
(6)已知:2KMnO4+7H2O2+3H2SO4→K2SO4+2MnSO4+6O2↑+10H2O,则被1mol KMnO4氧化的H2O2是______mol.
查看答案和解析>>
科目:gzhx
来源:2013-2014学年江西省九江市七校高三第二次联考化学试卷(解析版)
题型:填空题
氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识回答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为 ,反应中消耗1mol的MnO4—时转移电子数为 。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 。
查看答案和解析>>

![]() 2H++O2↑
2H++O2↑![]() Mn2++4H2O
Mn2++4H2O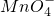 +5e-+8H+═Mn2++4H2O
+5e-+8H+═Mn2++4H2O +5e-+8H+═Mn2++4H2O
+5e-+8H+═Mn2++4H2O![]() 2H++O2↑
2H++O2↑![]() Mn2++4H2O
Mn2++4H2O