科目:gzhx 来源: 题型:实验题

| 试管编号 | 0.01mol/LKMnO4 | 0.5mol/LH2SO4 | 0.2mol/LH2C2O4 | H2O | 褪色时间/s |
| ① | 4mL | 5mL | 2mL | VmL | t1 |
| ② | 4mL | 5mL | 4mL | 7mL | t2 |
| ③ | 4mL | 5mL | 6mL | 5mL | t3 |
科目:gzhx 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:实验题
[化学——选修2化学与技术](15分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
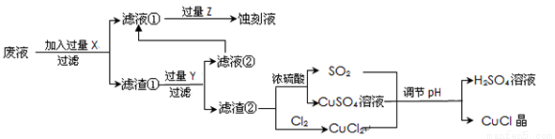
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是_____,现代氯碱工业的装置名称是_____________________。
(2)写出生产过程中X__________Y__________(填化学式)。
(3)写出产生CuCl的化学方程式________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_______________;生产过程中调节溶液的pH不能过大的原因是_____________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是______。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_______。
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+ =Fe3+ + Ce3+ 如此再重复二次测得:
1 | 2 | 3 | |
空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得该工业CuCl的纯度为_________(平行实验结果相差不能超过0.3%)
科目:gzhx 来源:河北省模拟题 题型:实验题
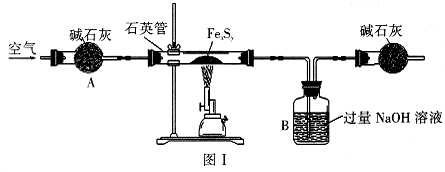
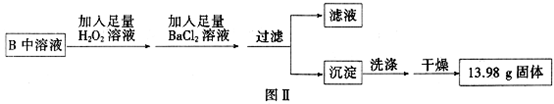
科目:gzhx 来源: 题型:阅读理解
某化学兴趣小组的同学在学习了《铝 金属材料》一节后,产生了浓厚的实验探究兴趣,欲对铝热反应进行实验探究。下面是他们活动的一则案例,请你帮助完成相关的内容,回答有关问题。
实验目的
1.观察铝热反应的现象,认识铝的还原性及其应用。
2.提高设计实验方案的能力及观察问题、分析问题的能力,增强实验探究意识。
实验原理
铝具有较强的还原性,在高温下,能把没有它活泼的金属从其氧化物中还原出来。
金属氧化物+铝 金属+氧化铝
金属+氧化铝
还原性:铝>金属
仪器和药品
蒸发皿、铁架台(带铁圈)、小试管、烧杯、药匙、坩埚钳、镊子、剪刀、火柴、砂纸、滤纸、长铁钉、砂子、三氧化二铁、铝粉、镁条、氯酸钾。
实验预测
铝是一种活泼金属,可能与其他金属的氧化物发生置换反应。
实验操作
甲同学在如图所示装置中加入药品(蒸发皿内盛有砂子)。
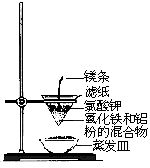
该同学引发铝热反应的实验操作是__________________。
实验现象
上述实验观察到的现象是_______________。
实验结论
在高温下,铝与氧化铁反应,放出大量的热。反应的化学方程式为_______________。
提出问题
乙同学对该实验进行了分析,发现存在几点明显不足:
1.因滤纸的遮挡、燃烧生成大量的烟和反应速率过快等而不易观察清楚红热现象。
2.铁珠四溅,容易发生事故。
实验改进
实验小组的同学积极思考,对实验进行了改进,取得了良好的效果。其改进实验如下: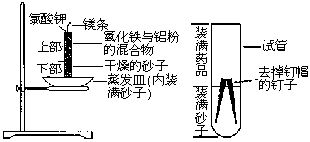
如上图所示连好装置,加好药品。其中蒸发皿中盛满砂子(用水润湿),在小试管内装入1/3干燥的砂子。用镊子向砂子中插入两支去掉钉帽的铁钉,将铁钉约1/4部分留在砂子外并用镊子将其靠紧。在砂子上面装满氧化铁和铝粉的混合物。在小试管上部放入少量氯酸钾粉末,并在其中插入一根镁条,点燃镁条。反应完全后,用坩埚钳夹住小试管的上端并将其敲断,倒出砂子并取出已焊接在一起的两支铁钉。
观察与思考
1.实验中氯酸钾和镁条的作用是什么?
2.你认为改进后的实验具有的优点是:_______________。
3.铝热反应有什么用途?
科目:gzhx 来源: 题型:
| ||

科目:gzhx 来源: 题型:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
科目:gzhx 来源: 题型:
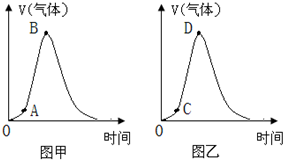
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
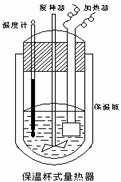 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
科目:gzhx 来源: 题型:
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
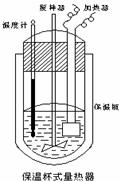 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
科目:gzhx 来源: 题型:阅读理解
| 名称 | 化学式 | 颜色、状态 | 溶解度(g) | 熔点(℃) | 密度(g/cm3) |
| 乙二酸 | H2C2O4 | ― | 8.6(20℃) | 189.5 | 1.900 |
| 二水合乙二酸 | H2C22・2H2O | 无色晶体 | ― | 101.5 | 1.650 |
注:乙二酸(HOOC―COOH)俗称草酸,带2个结晶水的乙二酸俗称草酸晶体,草酸晶体失去结晶水得无水草酸,在约157℃时升华,其盐草酸钙和草酸氢钙均为白色不溶物。
根据上述信息,回答下列问题。
(1)向盛有Na2CO3粉末的试管里加入约3mL乙二酸溶液,观察到的现象是 ,说明乙二酸的酸性比碳酸 (填“强”或“弱”)。
(2)向盛有5mL乙二酸饱和溶液的试管中滴入3滴用硫酸酸化的0.5%(质量分数)的高锰酸钾溶液,振荡,观察到的现象为 _______ ,说明乙二酸有_____ 性。
(3)向A试管中加入3mL乙二酸,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸,按下图甲连接好装置,加热3 -5min,在B管中有油状且带有香味的液体产生,该现象说明发生了 反应(填有机反应类型)。在B试管中加入饱和 Na2CO3溶液的目的是 。
B中导管口在液面上的原因是 。
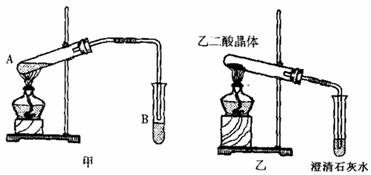
(4)已知草酸分解的化学方程式为:H2C2O4 ![]() H2O+CO2↑+CO↑,用图乙装置加热草酸晶体,验证草酸受热分解及其产物,但有人认为该装置不合理。请你根据相关信息的实验目的,分析不合理原因 (从下列序号中选择)。
H2O+CO2↑+CO↑,用图乙装置加热草酸晶体,验证草酸受热分解及其产物,但有人认为该装置不合理。请你根据相关信息的实验目的,分析不合理原因 (从下列序号中选择)。
a.草酸晶体的熔点较低,未分解之前就已融化并流到试管口,不利于化学反应的进行及实验现象的观察。
b.因为加热是草酸晶体,所以该装置最多只能检验一种分解产物,不能检验是否
还有其他分解产物。
c.在未洗气的情况下通入石灰水,还可能因草酸蒸汽与石灰水反应生成草酸钙沉淀,对实验有干扰。
(5)该装置也不附合绿色化学的要求试说明原因 。
科目:gzhx 来源: 题型:
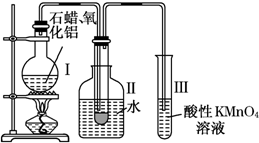 如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油.已知:石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态;石油催化裂化中通常使用Al2O3作催化剂.
如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油.已知:石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态;石油催化裂化中通常使用Al2O3作催化剂.科目:gzhx 来源: 题型:
(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |

请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
科目:gzhx 来源: 题型:
(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
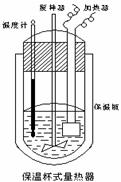 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
科目:gzhx 来源: 题型:
(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
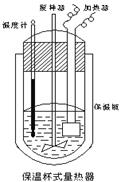 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
科目:gzhx 来源:0110 期末题 题型:实验题

 MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目,
MnCl2+Cl2↑+2H2O,请在该反应方程式中标出电子转移方向和数目,科目:gzhx 来源: 题型:


科目:gzhx 来源: 题型:实验题
(共14分)(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表: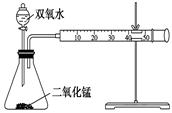
 MnO2 MnO2时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |

科目:gzhx 来源:2015届黑龙江省哈尔滨市高三第一次测试化学试卷(解析版) 题型:实验题
(共14分)(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:

时间 H2O2 |
0.1 g |
0.3 g |
0.8 g |
10 mL 1.5% | 223 s | 67 s | 56 s |
10 mL 3.0% | 308 s | 109 s | 98 s |
10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入___g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确___,理由是__________。(提示:H2O2的密度可认为近似相等)。
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似为1g·mL-1。

(1)试求CH3COOH的中和热△H=________________。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因________________。
(3)实验中NaOH过量的目的是________________。
科目:gzhx 来源: 题型:阅读理解
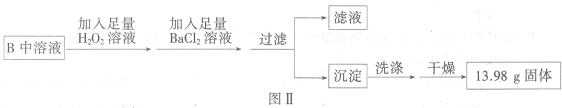
科目:gzhx 来源:2015-2016学年黑龙江牡丹江一中高一6月月考化学试卷(解析版) 题型:实验题
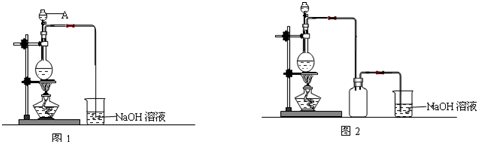
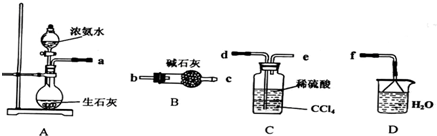
Ⅰ.如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH CH2===CH2↑+H2O,回答下列问题:
CH2===CH2↑+H2O,回答下列问题:
(1)图1中仪器①、②的名称分别为________、________。
(2)收集乙烯气体最好的方法是________。
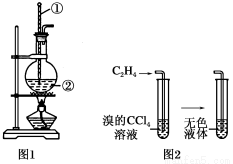
(3)向溴的四氯化碳溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于____(填反应类型),反应的化学方程式为_______。
Ⅱ.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题:
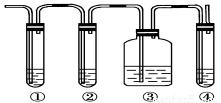
(1)图中①、②、③、④装置盛放的试剂是下列中的(将正确选项填入空格内):
①__________;②__________;③__________;④__________。
A.品红溶液 B.氢氧化钠溶液
C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明二氧化硫气体存在的现象是____________________。
(3)使用装置②的目的是________________________________。
(4)使用装置③的目的是_______________________________。
(5)验证含有乙烯的现象是________________________________。
科目:gzhx 来源: 题型:解答题