科目:czhx 来源: 题型:

| ||

科目:gzhx 来源:2013-2014学年河北衡水中学高三上学期期中考试化学试卷(解析版) 题型:选择题
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是( )
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同
D.AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同
科目:gzhx 来源: 题型:单选题
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是( )
| A.AlON和石英的化学键类型相同 |
| B.AlON和石英晶体类型相同 |
| C.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同 |
| D.AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同 |
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源:不详 题型:单选题
| A.AlON和石英的化学键类型相同 |
| B.AlON和石英晶体类型相同 |
| C.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同 |
| D.AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同 |
科目:gzhx 来源: 题型:
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是 ( )
A.AlON和石英的化学键类型相同 B.AlON和石英晶体类型相同
C.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同
D.AlON和(工业上通过电解法制备铝用的)Al2O3晶体 类型相同
科目:gzhx 来源: 题型:
| A、AlON和石英的化学键类型相同 |
| B、AlON和石英晶体类型相同 |
| C、AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同 |
| D、AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同 |
科目:gzhx 来源: 题型:
| ||
| A、氮氧化铝中氮的化合价是-3 |
| B、AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同 |
| C、反应中每生成5.7gAlON同时生成1.12LCO |
| D、反应中氧化产物和还原产物的物质的量之比是2:1 |
科目:gzhx 来源: 题型:
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是 ( )
A.AlON和石英的化学键类型相同 B.AlON和石英晶体类型相同
C.AlON和(工业上通过电解法制备铝用的)Al2O3的化学键类型不同
D.AlON和(工业上通过电解法制备铝用的)Al2O3晶体类型相同
科目:gzhx 来源:2016届浙江省高三上学期第二次月考化学试卷(解析版) 题型:选择题
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是
A.AlON和石英的化学键类型相同
B.AlON和石英晶体类型相同
C.AlON中N元素的化合价为-1
D.电解熔融AlON或电解熔融Al2O3都能得到Al
科目:czhx 来源: 题型:
| ||
| A、氧化铝等于铝加氧气 |
| B、氧化铝在通电的条件下生成了铝和氧气 |
| C、2个氧化铝生成了4个铝和3个氧气 |
| D、每10份质量的氧化铝在通电的条件下生成4份质量的铝和6份质量的氧气 |
科目:gzhx 来源: 题型:

科目:czhx 来源: 题型:单选题
 4Al+3O2↑的描述中,正确的是
4Al+3O2↑的描述中,正确的是科目:czhx 来源:不详 题型:单选题
| ||
| A.氧化铝等于铝加氧气 |
| B.氧化铝在通电的条件下生成了铝和氧气 |
| C.2个氧化铝生成了4个铝和3个氧气 |
| D.每10份质量的氧化铝在通电的条件下生成4份质量的铝和6份质量的氧气 |
科目:czhx 来源:2008-2009学年山东省淄博市高青县九年级(下)期中化学试卷(解析版) 题型:选择题
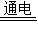 4Al+3O2↑的描述中,正确的是( )
4Al+3O2↑的描述中,正确的是( )科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:
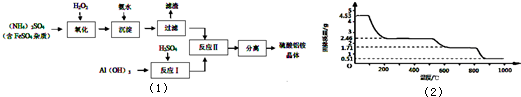
纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。[已知:硫酸铝铵晶体的化学式为(NH4)Al (SO4)n·12H2O]
制备硫酸铝铵晶体的实验流程如下:
 |
(1)检验上述流程中“过滤”后杂质是否除尽的实验方法是 。
(2)上述流程中,“分离”所包含的操作依次为: 、 、过滤、洗涤、干燥。
(3)硫酸铝铵水溶液呈酸性的原因是 (用离子方程式表示)。
(4)写出上述“反应Ⅱ”中获得硫酸铝铵晶体的化学方程式 。
(5)向硫酸铝铵溶液中加入氢氧化钡溶液至Al3+刚好沉淀完全,写出反应的离子方程式 。
(6)取4.53 g硫酸铝铵晶体加热分解,加热过程中,固体质量随时间的变化如下图所示:

写出400℃时剩余固体成分的化学式 。
科目:gzhx 来源:2012-2013学年安徽省蚌埠二中高三暑期测试化学试卷(解析版) 题型:填空题

科目:czhx 来源:山东省期中题 题型:单选题
 4Al+3O2↑的描述中,正确的是
4Al+3O2↑的描述中,正确的是科目:czhx 来源: 题型:解答题