
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源:2016届辽宁省高三全真模拟理综化学试卷(解析版) 题型:实验题
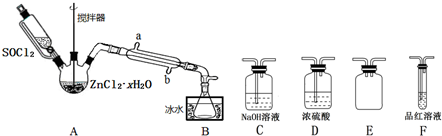
二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些支持装置省略了)所示。
已知:SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
(1)E中的试剂是饱和食盐水,戊是贮气装置,则F瓶中气体的实验室制法是_______(用方程式表示);
(2)B处反应管冷却水应从___________(填“a”或“b”)接口通入;
(3)装置乙和丁的作用是___________;
(4)恒压漏斗具有特殊的结构,主要目的是___________;
(5)写出二氯化砜(SO2Cl2)水解反应的方程式___________;
(6)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸,选用下面的装置和药品探究亚硫酸与次氯酸的酸性性强弱

装置连接顺序为A、_____、_____、_____、D、F,其中装置C的作用是_____,通过__________________________现象即可证明亚硫酸的酸性强于次氯酸。
科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:

| Li |
| Li+ |
| Cl2 |
| Cl- |
| S |
| S2- |
| S4+ |
| S |
科目:gzhx 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:选择题
氯化亚砜(SOCl2,结构式如图)主要用于制造酰基氯化物,其工业制备原理:SO3+SCl2=SOCl2+SO2,

下列有关说法正确的是
A.SCl2和SOCl2中S的化合价分别为+2、+4价
B.制备反应中,二氧化硫是氧化产物
C.每消耗1mol SCl2,转移1mol电子
D.SOCl2分子中既含有离子键又含有共价键
科目:gzhx 来源:肇庆一模 题型:多选题
| A.放电时电池内部Li+向负极移动 |
| B.放电过程中,电池负极材料的质量减少 |
| C.放电时电池正极反应为:2SOCl2+4e-=SO2+S+4Cl- |
| D.放电时每转移4mol电子,有2mol S被还原 |
科目:gzhx 来源:2009年广东省肇庆市高考化学一模试卷(解析版) 题型:选择题
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:填空题
 氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:
氯化亚砜(SOCl2)液体是一种重要的有机合成试剂,还用于农药、医药、燃料的生产等.回答下列问题:科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:填空题
科目:gzhx 来源: 题型:
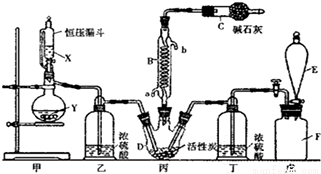
二茂铁(结构如图)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到。反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁的熔点为172~173℃,在100℃开始升华。能溶于乙醚、二甲亚砜等非极性溶剂,不溶于水,对碱和非氧化性酸稳定。制备的步骤如下:
步骤1.在150mL的三颈瓶中加入25g细粉末状KOH和60mL无水乙醚,通入氮气并搅拌约10分钟使之尽可能溶解,然后加入5.5 mL环戊二烯,再搅拌10分钟。
步骤2. 向烧杯中加入25 mL二甲亚砜和6.5g新制的无水氯化亚铁,微热至40℃并搅拌使其溶解,然后加入滴液漏斗中。
步骤3. 按图所示的装置装配好仪器,打开滴液漏斗的活塞,缓慢将氯化亚铁等加入三颈瓶中,并继续搅拌1小时。
步骤4. 反应结束后,将混合物倒入100mL 18%的盐酸溶液,将烧杯放在冰浴中冷却,搅拌约10分钟,使结晶完全。
步骤5. 抽滤,将获得的产品以冷水洗涤2~3次,低温风干得到粗制的二茂铁。
(1)步骤1中通入N2的目的可能是 。
(2)步骤2中,滴液漏斗侧边的玻璃导管的作用是 。
(3)实验装置中,冷凝管通水,水应从 口进(选填a或b)。
(4)步骤4将反应后的混合物倒入盐酸中,发生主要反应的离子方程式是 。
(5)步骤5用冷水洗涤是因为 ,因此可采用 的方法,进一步提纯二茂铁。
科目:gzhx 来源: 题型:
二茂铁(结构如图)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到。反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁的熔点为172~173℃,在100℃开始升华。能溶于乙醚、二甲亚砜等非极性溶剂,不溶于水,对碱和非氧化性酸稳定。制备的步骤如下:
步骤1.在150mL的三颈瓶中加入25g细粉末状KOH和60mL无水乙醚,通入氮气并搅拌约10分钟使之尽可能溶解,然后加入5.5 mL环戊二烯,再搅拌10分钟。
步骤2. 向烧杯中加入25 mL二甲亚砜和6.5g新制的无水氯化亚铁,微热至40℃并搅拌使其溶解,然后加入滴液漏斗中。
步骤3. 按图所示的装置装配好仪器,打开滴液漏斗的活塞,缓慢将氯化亚铁等加入三颈瓶中,并继续搅拌1小时。
步骤4. 反应结束后,将混合物倒入100mL 18%的盐酸溶液,将烧杯放在冰浴中冷却,搅拌约10分钟,使结晶完全。
步骤5. 抽滤,将获得的产品以冷水洗涤2~3次,低温风干得到粗制的二茂铁。
(1)步骤1中通入N2的目的可能是 。
(2)步骤2中,滴液漏斗侧边的玻璃导管的作用是 。
(3)实验装置中,冷凝管通水,水应从 口进(选填a或b)。
(4)步骤4将反应后的混合物倒入盐酸中,发生主要反应的离子方程式是 。
(5)步骤5用冷水洗涤是因为 ,因此可采用 的方法,进一步提纯二茂铁。
科目:gzhx 来源:2012届江苏省苏北四市(徐、淮、连、宿)高三3月联考化学试卷(带解析) 题型:实验题
二茂铁(结构如图)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到。反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O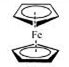
二茂铁的熔点为172~173℃,在100℃开始升华。能溶于乙醚、二甲亚砜等非极性溶剂,不溶于水,对碱和非氧化性酸稳定。制备的步骤如下:
步骤1.在150mL的三颈瓶中加入25g细粉末状KOH和60mL无水乙醚,通入氮气并搅拌约10分钟使之尽可能溶解,然后加入5.5 mL环戊二烯,再搅拌10分钟。
步骤2. 向烧杯中加入25 mL二甲亚砜和6.5g新制的无水氯化亚铁,微热至40℃并搅拌使其溶解,然后加入滴液漏斗中。
步骤3. 按图所示的装置装配好仪器,打开滴液漏斗的活塞,缓慢将氯化亚铁等加入三颈瓶中,并继续搅拌1小时。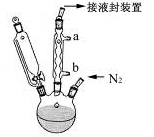
步骤4. 反应结束后,将混合物倒入100mL 18%的盐酸溶液,将烧杯放在冰浴中冷却,搅拌约10分钟,使结晶完全。
步骤5. 抽滤,将获得的产品以冷水洗涤2~3次,低温风干得到粗制的二茂铁。
(1)步骤1中通入N2的目的可能是 。
(2)步骤2中,滴液漏斗侧边的玻璃导管的作用是 。
(3)实验装置中,冷凝管通水,水应从 口进(选填a或b)。
(4)步骤4将反应后的混合物倒入盐酸中,发生主要反应的离子方程式是 。
(5)步骤5用冷水洗涤是因为 ,因此可采用 的方法,进一步提纯二茂铁。
科目:gzhx 来源:2011-2012学年江苏省苏北四市(徐、淮、连、宿)高三3月联考化学试卷(解析版) 题型:实验题
二茂铁(结构如图)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到。反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O

二茂铁的熔点为172~173℃,在100℃开始升华。能溶于乙醚、二甲亚砜等非极性溶剂,不溶于水,对碱和非氧化性酸稳定。制备的步骤如下:
步骤1.在150mL的三颈瓶中加入25g细粉末状KOH和60mL无水乙醚,通入氮气并搅拌约10分钟使之尽可能溶解,然后加入5.5 mL环戊二烯,再搅拌10分钟。
步骤2. 向烧杯中加入25 mL二甲亚砜和6.5g新制的无水氯化亚铁,微热至40℃并搅拌使其溶解,然后加入滴液漏斗中。
步骤3. 按图所示的装置装配好仪器,打开滴液漏斗的活塞,缓慢将氯化亚铁等加入三颈瓶中,并继续搅拌1小时。
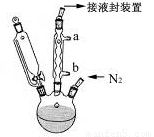
步骤4. 反应结束后,将混合物倒入100mL 18%的盐酸溶液,将烧杯放在冰浴中冷却,搅拌约10分钟,使结晶完全。
步骤5. 抽滤,将获得的产品以冷水洗涤2~3次,低温风干得到粗制的二茂铁。
(1)步骤1中通入N2的目的可能是 。
(2)步骤2中,滴液漏斗侧边的玻璃导管的作用是 。
(3)实验装置中,冷凝管通水,水应从 口进(选填a或b)。
(4)步骤4将反应后的混合物倒入盐酸中,发生主要反应的离子方程式是 。
(5)步骤5用冷水洗涤是因为 ,因此可采用 的方法,进一步提纯二茂铁。
科目:gzhx 来源:2011-2012学年福建省福州市高三第一学期期末质量检查考试化学试卷 题型:实验题
二茂铁(结构如图)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到。反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O

二茂铁的熔点为172~173℃,在100℃开始升华。能溶于乙醚、二甲亚砜等非极性溶剂,不溶于水,对碱和非氧化性酸稳定。制备的步骤如下:
步骤1.在150mL的三颈瓶中加入25g细粉末状KOH和60mL无水乙醚,通入氮气并搅拌约10分钟使之尽可能溶解,然后加入5.5 mL环戊二烯,再搅拌10分钟。
步骤2. 向烧杯中加入25 mL二甲亚砜和6.5g新制的无水氯化亚铁,微热至40℃并搅拌使其溶解,然后加入滴液漏斗中。
步骤3. 按图所示的装置装配好仪器,打开滴液漏斗的活塞,缓慢将氯化亚铁等加入三颈瓶中,并继续搅拌1小时。
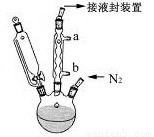
步骤4. 反应结束后,将混合物倒入100mL 18%的盐酸溶液,将烧杯放在冰浴中冷却,搅拌约10分钟,使结晶完全。
步骤5. 抽滤,将获得的产品以冷水洗涤2~3次,低温风干得到粗制的二茂铁。
(1)步骤1中通入N2的目的可能是 。
(2)步骤2中,滴液漏斗侧边的玻璃导管的作用是 。
(3)实验装置中,冷凝管通水,水应从 口进(选填a或b)。
(4)步骤4将反应后的混合物倒入盐酸中,发生主要反应的离子方程式是 。
(5)步骤5用冷水洗涤是因为 ,因此可采用 的方法,进一步提纯二茂铁。
科目:gzhx 来源:不详 题型:实验题


科目:gzhx 来源: 题型:
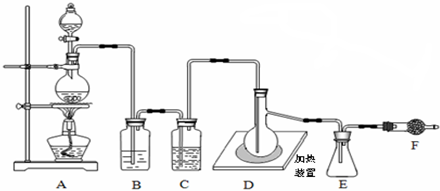
 )是一种典型的金属有机化合物,实验室常用新制氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O.二茂铁的熔点为172~173℃,在100℃开始升华.能溶于乙醚、二甲亚砜等溶剂,不溶于水,对碱和非氧化性酸稳定.某研究小组设计的实验方案和制备装置示意图如下:
)是一种典型的金属有机化合物,实验室常用新制氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O.二茂铁的熔点为172~173℃,在100℃开始升华.能溶于乙醚、二甲亚砜等溶剂,不溶于水,对碱和非氧化性酸稳定.某研究小组设计的实验方案和制备装置示意图如下: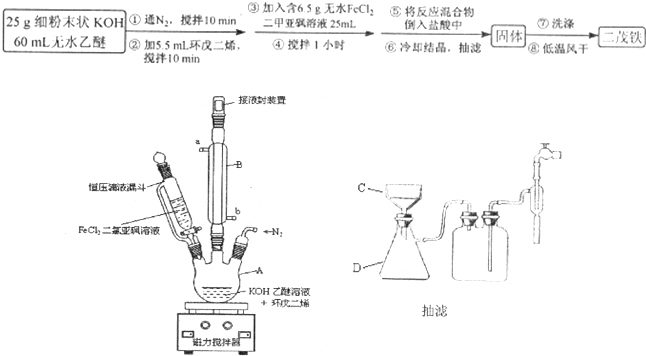
科目:gzhx 来源: 题型:
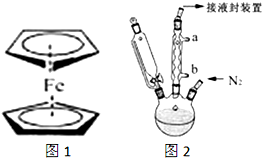 二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O