
科目:czhx 来源:三点一测全书 九年级化学 上 题型:038
葡萄糖酸亚铁是治疗缺铁性贫血的一种药品,它的化学式为C12H22FeO14,已知碳原子的相对原子质量为12,氢为1,铁为56,氧为16,试计算:
(1)葡萄糖酸亚铁的化学式量.
(2)葡萄糖酸亚铁中铁元素的质量百分含量.
(3)若某病人需补充2.8g铁元素,医生应开给病人多少克葡萄糖酸亚铁?
科目:gzhx 来源:2016届山东省威海市乳山市高三上学期期中测试化学试卷(解析版) 题型:填空题
以下是利用主要成分为Cu2S和Fe2O3的工业废弃固体(其他成分不参与反应)制备有关物质,实验流程如图所示:
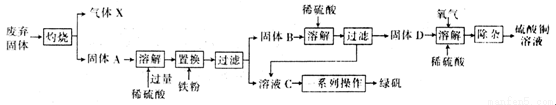
回答下列问题:
(1)气体X的化学式为 。
(2)加入铁粉时发生反应的离子方程式为:2H++Fe Fe2++H2↑、 。
Fe2++H2↑、 。
(3)常温下,固体D、O2和稀硫酸混合后几乎不反应,而加少量绿矾后随即发生反应。已知FeSO4对此反应起催化作用,则催化过程中反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O、 。
(4)除杂时需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,则氧化剂及试剂Y可以是 (填编号)。
a.H2O2、CuO b.HNO3、Cu(OH)2
c.KMnO4、CuCl2 d.漂白粉、CuCO3
(5)无水硫酸铜受热分解生成氧化铜和气体,受热温度不同气体可能为SO3、SO2和O2中的一种、两种或三种。现设计如下实验测定产生的SO2、SO3和O2的物质的量,并计算各物质的化学计量数,从而确定CuSO4分解的化学方程式(已知实验结束时,硫酸铜完全分解)。
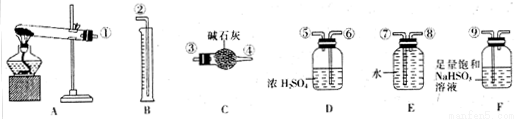
①仪器C的名称是 。
②组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
①→⑨→⑩→⑥→⑤→ → → → →②(填接口序号)。仪器F的作用是 。
③若某小组称取6.4g无水CuSO4,实验过程中装置C增加的质量为3.84g,量筒中水的体积折算成标准状况下气体体积224mL,请通过计算确定实验条件下CuSO4分解的化学方程式: 。
科目:gzhx 来源:2009年广东省高考化学模拟试卷(二)(解析版) 题型:解答题
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |

科目:gzhx 来源: 题型:解答题
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |

科目:gzhx 来源: 题型:阅读理解
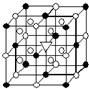 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
科目:gzhx 来源: 题型:阅读理解
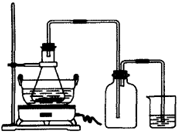 绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
科目:gzhx 来源: 题型:解答题
 绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
科目:gzhx 来源:广东模拟 题型:问答题
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |

科目:gzhx 来源: 题型:阅读理解
 (2009•广东模拟)绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(2009•广东模拟)绿矾(FeSO4•7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
科目:gzhx 来源: 题型:阅读理解

- 4 |
| 1000.00 mL |
| 20.00 mL |
| 10 g×20.00%-1.68 g |
| 10 g×20.00% |
| 1000.00 mL |
| 20.00 mL |
| 10 g×20.00%-1.68 g |
| 10 g×20.00% |
科目:gzhx 来源: 题型:阅读理解
| 7cV |
| 125a |
| 7cV |
| 125a |

科目:gzhx 来源:山东省潍坊市三县市2012届高三上学期期中联合考试化学试题 题型:058
为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0 g放入30.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
(1)甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)________________.
供选用试剂:a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.浓氨水
d.酸性KMnO4溶液
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案Ⅰ.取672 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g.
方案Ⅱ.向V mL c mol·L-1酸性高猛酸钾溶液中缓慢通入Y气体a L(标准状况),溶液恰好完全褪色.
方案Ⅲ,取V L(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg.
①其中不合理的方案是________,理由是________.
②选择合理方案的数据计算气体Y中SO2的体积分数(用含未知数的代数式表示)________.
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持装置已省略).

(3)装置A中试剂的作用是________.
(4)简述确认气体Y中含有CO2的实验现象:________.
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠?________(填“可靠”或“不可靠”),简述理由:________.
科目:gzhx 来源:广东模拟 题型:问答题

科目:gzhx 来源: 题型:阅读理解
【规格】 每片含琥珀酸亚铁 【适应症】 用于缺铁性贫血症,预防及治疗用 【用量用法】 成人预防量 【贮藏】 避光、密封、在干燥处保存 |
(1)该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10.00%即不能再服用。
①为了检验某药店出售的“速力菲”是否氧化,实验室应选用的检验试剂为__________(填试剂的名称);
②实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中,其他成分不与KMnO4反应)。请配平下列离子方程式。
__________![]() +__________Fe2++__________H+
+__________Fe2++__________H+![]() __________Mn2++__________Fe3++__________H2O
__________Mn2++__________Fe3++__________H2O
③称量上述含铁元素质量分数为20.00%的“速力菲”
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸。含
科目:gzhx 来源:2013-2014学年福建省漳州市高三3月质检理综化学试卷(解析版) 题型:填空题
氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题:
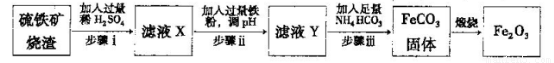
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、ⅱ、ⅲ都要进行的操作名称是__________________。
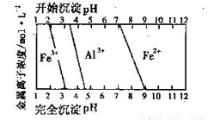
(5)结合下图,判断步骤ⅱ中调节溶液的pH不高于_________________。
(6)已知

计算反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。
(7)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(8)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案。
科目:gzhx 来源:2012-2013学年安徽省黄山市毕业班第一次质量检测化学试卷(解析版) 题型:实验题
铁及其化合物在生产和生活中有着广泛的应用。
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:

①操作Ⅰ、Ⅱ的名称分别是____、____。
②写出在空气中煅烧FeCO3的化学方程式 ;
③煅烧如果不充分,产品中将有Fe2+ 存在,试设计实验检验产品中有无Fe2+ 。
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;量取25.00mL待测溶液于锥形瓶中;用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式
②计算上述样品中FeSO4·7H2O的质量分数为 [已知M(FeSO4·7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为
④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视
科目:gzhx 来源: 题型:填空题
氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题: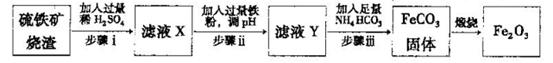
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、ⅱ、ⅲ都要进行的操作名称是__________________。
(5)结合下图,判断步骤ⅱ中调节溶液的pH不高于_________________。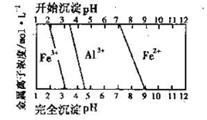
(6)已知
计算反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。
(7)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(8)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案。
科目:gzhx 来源: 题型:实验题
铁及其化合物在生产和生活中有着广泛的应用。
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题: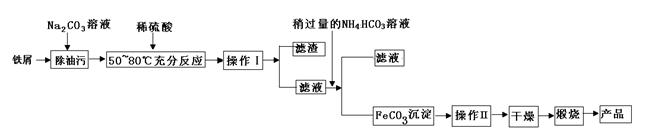
①操作Ⅰ、Ⅱ的名称分别是____、____。
②写出在空气中煅烧FeCO3的化学方程式 ;
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+。
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;量取25.00mL待测溶液于锥形瓶中;用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式
②计算上述样品中FeSO4·7H2O的质量分数为 [已知M(FeSO4·7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为
④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视
科目:gzhx 来源: 题型:解答题

科目:gzhx 来源:山东省期中题 题型:实验题
