
科目:gzhx 来源: 题型:阅读理解
| 15 | 16 |
科目:gzhx 来源:江西省白鹭洲中学2012届高三上学期期中考试化学试题 题型:022
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气.反应为:N2(g)+3H2(g)![]() 2NH3(g);ΔH<0.
2NH3(g);ΔH<0.
①下列措施可以提高H2的转化率的是(填选项序号)________.
a.选择适当的催化剂
b.增大压强
c.及时分离生成的NH3
d.升高温度
②一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率α1=________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2________α1(填“>”、“<”或“=”).
,则N2的转化率α1=________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2________α1(填“>”、“<”或“=”).
(2)以氨气、空气为主要原料制硝酸.
在容积恒定的密闭容器中进行反应2NO(g)+O2(g)![]() 2NO2(g);ΔH>0.
2NO2(g);ΔH>0.
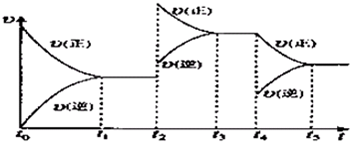
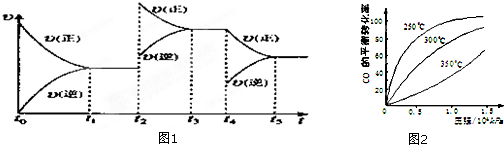
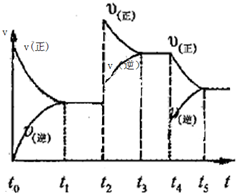
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t2,t4时刻只改变一个条件,下列说法正确的是(填选项序号)________.
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气.
①催化还原法:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g);ΔH=+67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是________.
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式是________.
科目:gzhx 来源: 题型:
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率
,则N2的转化率![]() ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为![]() ,则
,则![]()
![]() (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1. 0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
科目:gzhx 来源: 题型:
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入ImolN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率
,则N2的转化率![]() ;若容器压强恒定,达到平衡状态时,N=的转化率为
;若容器压强恒定,达到平衡状态时,N=的转化率为![]() ,则
,则![]()
![]() (‘填“>”、“<”或“=”)。
(‘填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2![]() 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以3.4吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为
吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
科目:gzhx 来源:专项题 题型:填空题
 4NO+6H2O,4NO+3O2+2H2O=4HNO3
4NO+6H2O,4NO+3O2+2H2O=4HNO3 科目:gzhx 来源:0110 模拟题 题型:填空题
 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3 科目:gzhx 来源:江苏模拟题 题型:填空题
 ,则N2的转化率а1=_________;若容器压强恒定,达到平衡状态时,N2的转化率为а2,则а2____(填“>”“<”或 “=”)а1。
,则N2的转化率а1=_________;若容器压强恒定,达到平衡状态时,N2的转化率为а2,则а2____(填“>”“<”或 “=”)а1。 4NO+ 6H2O;
4NO+ 6H2O;科目:gzhx 来源:江苏模拟题 题型:填空题
 4NO+6H2O,4NO+3O2+2H2O=4HNO3
4NO+6H2O,4NO+3O2+2H2O=4HNO3 科目:gzhx 来源: 题型:阅读理解
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下。
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g)![]() 2NH3(g)△H<0
2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的![]() ,则N2的转化率a1= ;
,则N2的转化率a1= ;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2 a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是 。
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)![]() 2NO2(g):△H>0
2NO2(g):△H>0
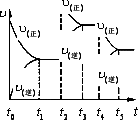
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。

a.在t1~t??2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态;
b.在t2时,采取的措施可以是升高温度;
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态;
d.在t5时,容器内NO2的体积分数是整个过程中的最大值。(3)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g): △H=-483.6kJ/mol
N??2(g)+2O2(g)=2NO2(g): △H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是 。
科目:gzhx 来源: 题型:阅读理解
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
①下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的理是原来的![]() ,则N2的转化率a1= ;
,则N2的转化率a1= ;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2 a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是 。
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)![]() 2NO2(g)△H>0
2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
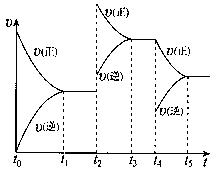
a.在t1~t??2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3~ t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
N??2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2gNO2和Na2FCO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是 。
科目:gzhx 来源:广西柳铁一中2010-2011学年高三第二次月考 题型:填空题
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下。
 (1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g) 2NH3(g)△H<0
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g) 2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的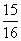 ,则N2的转化率a1=
;
,则N2的转化率a1=
;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2 a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是 。
 ②在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g):△H>0
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g):△H>0
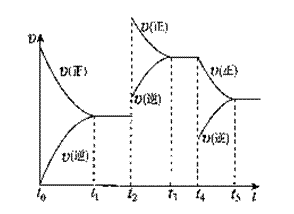 该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
。
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)
。
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态;
b.在t2时,采取的措施可以是升高温度;
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态;
d.在t5时,容器内NO2的体积分数是整个过程中的最大值。(3)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g): △H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g): △H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应的离子方程式是 。
科目:gzhx 来源:江西省期中题 题型:填空题
 2NH3(g)
2NH3(g) 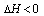 。
。  ,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2______α1(填“>”、“<”或“=”)。
,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2______α1(填“>”、“<”或“=”)。  2NO2(g)
2NO2(g) 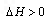 。该反应的反应速率(
。该反应的反应速率(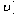 )随时间(t)变化的关系如图所示。若 时刻只改变一个条件,下列说法正确的是(填选项序号)_________。
)随时间(t)变化的关系如图所示。若 时刻只改变一个条件,下列说法正确的是(填选项序号)_________。 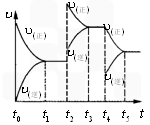
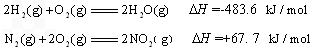
 溶液吸收NO2生成CO2。若
溶液吸收NO2生成CO2。若 和
和 溶液完全反应时转移电子0.1 mol,则反应的离子方程式是______________________。
溶液完全反应时转移电子0.1 mol,则反应的离子方程式是______________________。 科目:gzhx 来源: 题型:
| 15 |
| 16 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
 硝酸是一种重要的化工原料.
硝酸是一种重要的化工原料.| 15 |
| 16 |
科目:gzhx 来源: 题型:
| 15 |
| 16 |
| ||
| △ |
科目:gzhx 来源: 题型:
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下。
(1)以N2和H2为原料合成氨气。反应:N2(g)+3H2(g) 2NH3(g) ΔH<0。
2NH3(g) ΔH<0。
①该反应的化学平衡常数表达式是K= 。
②该反应的化学平衡常数K与温度T的关系如下表所示:
| T / K | 473 | 573 | 673 | …… |
| K | 4.4×10-2 | K1 | K2 | …… |
其中,K1 K2(填“>”、“=”或“<”)。
③ 下列措施可以提高H2的转化率的是(填选项序号)____________________。
a.选择适当的催化剂
b.增大压强
c.及时分离生成的NH3
d.升高温度
④ 一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应。
(Ⅰ)若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,
,
求N2的转化率α1。(用三列式作答,要求写出计算过程)
(Ⅱ)若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2 α1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
① NH3被氧气催化氧化生成NO的反应的化学方程式是_________________。
② 在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) ΔH>0。该反应的反应速率(υ)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)___________________。
2NO2(g) ΔH>0。该反应的反应速率(υ)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)___________________。
 |
a.在t1 ~ t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3 ~ t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g)=2H2O(g) ΔH=— 483.6 kJ/mol
N2(g) + 2O2(g)=2NO2(g) ΔH=+ 67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是_____________ 。
科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题
