
科目:gzhx 来源: 题型:解答题
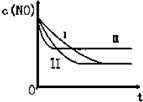 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)⇌2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
科目:gzhx 来源:2016届河南省高三三模理综化学试卷(解析版) 题型:填空题
(1)烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ mol-1
mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ mol-1
mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ mol-1
mol-1
则反应3NO(g)+O3(g)=3NO2(g)的△H=_______KJ/mol。
(2)在Cu2O/ZnO做催化剂的条件下,将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如下图所示:

根据题意回答下列问题:
①在300℃时,平衡常数K= ;
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2) = 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(CO) /n(CH3OH)增大
(3)利用CO和H2还可以制备二甲醚。将合成气以n(H2)/n(CO)=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法不正确的是 。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法不正确的是 。
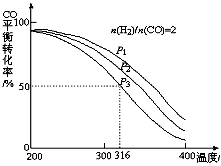
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率大于50%
(4) 25℃,两种酸的电离平衡常数如下表。

①HSO3-的电离平衡常数表达式K= 。
②0.10 mol L-1NaHSO3溶液中离子浓度由大到小的顺序为 。
L-1NaHSO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
科目:gzhx 来源: 题型:
| 1 |
| 2 |
科目:gzhx 来源: 题型:
 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应: ,是导致汽车尾气中含有NO的原因之一。
,是导致汽车尾气中含有NO的原因之一。
①在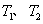 温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应
温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应 __________0(填“>”或“<”)。
__________0(填“>”或“<”)。
②在 温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率
温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率 ___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
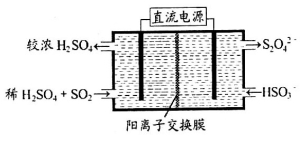
 (2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L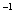 的醋酸与b mol
的醋酸与b mol L
L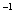
 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在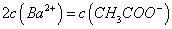 ,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
科目:gzhx 来源: 题型:
 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应: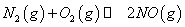 ,是导致汽车尾气中含有NO的原因之一。
,是导致汽车尾气中含有NO的原因之一。
①在 温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应
温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应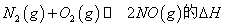 __________0(填“>”或“<”)。
__________0(填“>”或“<”)。
②在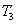 温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率
温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率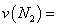 ___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
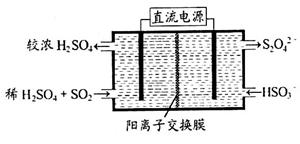 (2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有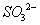 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L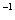 的醋酸与b mol
的醋酸与b mol L
L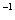
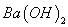 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在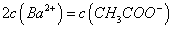 ,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
科目:gzhx 来源: 题型:
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
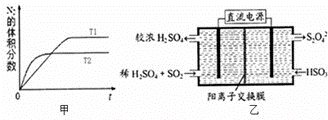
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一.
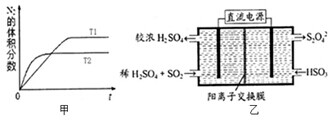
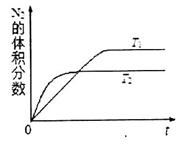
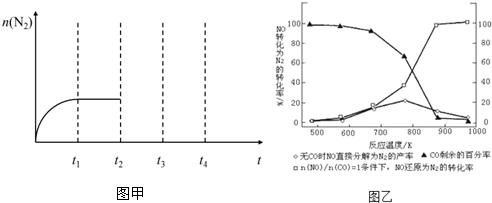
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图甲所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H 0(填“>”或“<”).
②在T3温度下,向2L密闭容器中充入10mol N2与5mol O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)= .该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为 .
(2)利用如图乙所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2.
①阳极的电极反应式为 .
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32﹣生成.该反应中氧化剂与还原剂的物质的量之比为 .
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染.常温下,将a mol•L﹣1的醋酸与b mol•L﹣1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)═c(CH3COO﹣),则该混合溶液中醋酸的电离常数Ka= (用含a和b的代数式表示).
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42﹣互为等电子体的分子 .
科目:gzhx 来源: 题型:问答题
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。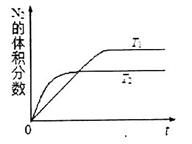
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。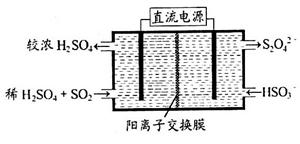
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L 的醋酸与b mol
的醋酸与b mol L
L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
科目:gzhx 来源:2013-2014山东省日照市高三5月二模理综化学试卷(解析版) 题型:简答题
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。
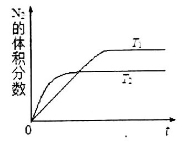
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L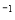 的醋酸与b mol
的醋酸与b mol L
L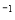 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:
| 15 |
| 16 |
科目:gzhx 来源:2013-2014学年山东省烟台市高三3月模拟化学试卷(解析版) 题型:填空题
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)  H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)  H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)  H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 。
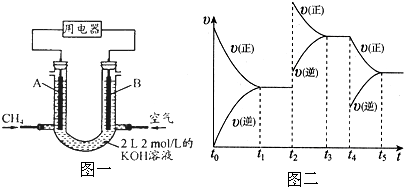
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
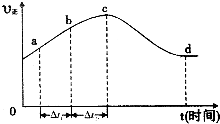
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。
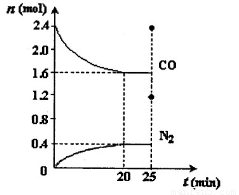
①NO的平衡转化率为 ,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
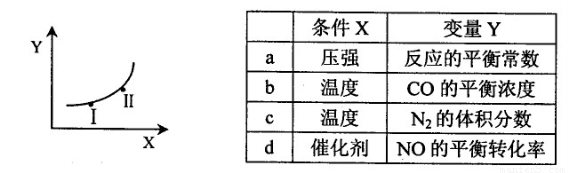
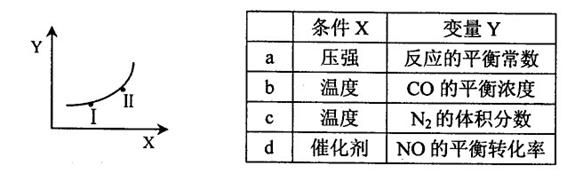
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。
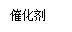
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
a.放电过程中,电解质溶液的pH保持不变
b.溶液中的NH4Cl浓度增大,但Cl-离子浓度不变
c.每转移6.02 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化
d.为保持放电效果,电池使用一段时间需更换电解质溶液
科目:gzhx 来源: 题型:填空题
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)  H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)  H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)  H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)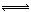 N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。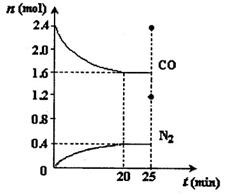
①NO的平衡转化率为 ,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。
|
 (3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化科目:gzhx 来源:不详 题型:填空题
 H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1; H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1; H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。 N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
|
 (3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化科目:gzhx 来源: 题型:
| 1 |
| 4 |
| 1 |
| 2 |

科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题
科目:gzhx 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:简答题
(14分)发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g) CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
(2)CO2制备甲醇:CO2(g)+3H2(g)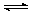 CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
①该反应化学平衡常数K的表达式是________。
②0~9min时间内,该反应的平均反应速率ν(H2)=________。
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a.0<Q<29.5
B.29.5<Q<36.75
C.36.75<Q<49
D.49<Q<98
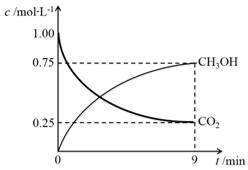
④在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如右图所示,L和X分别表示温度或压强。
X表示的物理量是。判断L1与L2的大小关系。
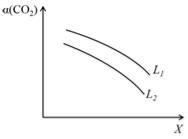
(3)科学家用氮化镓材料与铜组装如右图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.
写出铜电极表面的电极反应式,为提高该人工光合系统的工作效率,可向装置中加入少量(选填“盐酸”或“硫酸”).
(4)利用CO2和NH3为原料也合成尿素,在合成塔中的主要反应可表示如下:
反应①:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=__________________
反应②:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-86.98kJ·mol-1;
则反应①的△H1=_______________。
(5)现将amol铁和bmol铜的混合物与含有cmolHNO3的稀溶液充分反应,设还原产物为NO。下列结论不正确的是(填序号)
A.若剩余金属0.5amol,则氧化产物为一种或二种
B.若只有一种氧化产物,则3c=8a
C.若有二种氧化产物,被还原的硝酸物质的量为0.25cmol
D.若有三种氧化产物,被还原的硝酸物质的量为0.25cmol