
科目:gzhx 来源:2016年全国普通高等学校招生统一考试化学(新课标1卷精编版) 题型:填空题
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
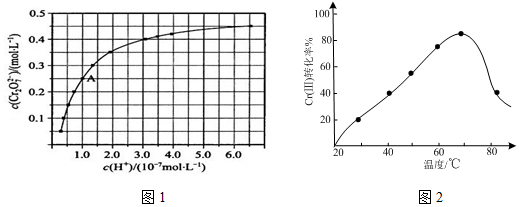
(2)CrO42−和Cr2O72−在溶液中可相互转化。室温下,初始浓度为1.0 mol L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。
L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42−的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42−的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为_______ mol L−1,此时溶液中c(CrO42−)等于__________ mol
L−1,此时溶液中c(CrO42−)等于__________ mol L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72−还原成Cr3+,该反应的离子方程式为______________。
科目:gzhx 来源:2017届四川省、温江中学等五校高三上第一次联考化学卷(解析版) 题型:填空题
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____ _____。
(2)CrO42−和Cr2O72−在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应 。
②由图可知,溶液酸性增大,CrO42−的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42−的平衡转化率减小,则该反应的ΔH________0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好沉淀完全(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为_______ mol·L−1,此时溶液中c(CrO42−)等于__________ mol·L−1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72−还原成Cr3+,该反应的离子方程式为 。
科目:gzhx 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:填空题
查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于_______________(选填编号)。
a.主族元素 b.副族元素 c.Ⅷ族元素 d.过渡元素
(2)铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;与Ni等添加到Fe中可制成不锈钢。比较硬度:纯铁_________不锈钢;熔点:纯铁__________不锈钢(填“>”“<”或“=”)。
(3)Cr(OH)3与Al(OH)3的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________________。
(4)CrO42−和Cr2O72−在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。
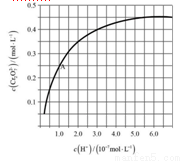
①用离子方程式表示Na2CrO4溶液中的转化反应____________________。
②由图可知,溶液酸性增大,CrO42−的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42−的平衡转化率减小,则该反应的ΔH__________0(填“>”“<”或“=”)。
(5)+6价铬的化合物毒性较大,但其化合物用途广泛。如:“酒精检测仪”可检查司机是否酒驾,其反应原理为:m C2H5OH+ n X + p H2SO4═ g Cr2(SO4)3 + w CO2↑+ 9H2O,其中X的化学式最有可能为__________。常用NaHSO3将酸性废液中的Cr2O72−还原成Cr3+,该反应的离子方程式为_______________。
科目:gzhx 来源:2016年全国普通高等学校招生统一考试化学(全国1卷参考版) 题型:简答题
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42−和Cr2O72−在溶液中可相互转化。室温下,初始浓度为1.0 mol·L−1的Na2CrO4溶液中c(Cr2O72−)随c(H+)的变化如图所示。
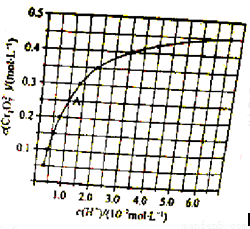
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42−的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42−的平衡转化率减小,则该反应的ΔH_________(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl−,利用Ag+与CrO42−生成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶液中c(Ag+)为_______ mol·L−1,此时溶液中c(CrO42−)等于__________ mol·L−1。(已知Ag2 CrO4、AgCl的Ksp分别为2.0×10−12和2.0×10−10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72−还原成Cr3+,反应的离子方程式为______________。
科目:gzhx 来源: 题型:解答题
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:科目:gzhx 来源: 题型:解答题
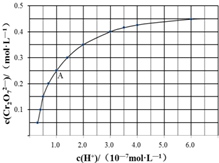 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:科目:gzhx 来源: 题型:解答题
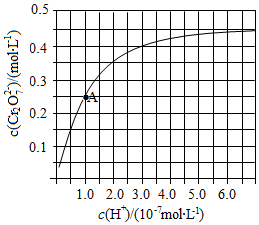 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:科目:gzhx 来源: 题型:解答题

科目:gzhx 来源: 题型:解答题
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:科目:gzhx 来源: 题型:填空题
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:解答题
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:科目:gzhx 来源: 题型:解答题
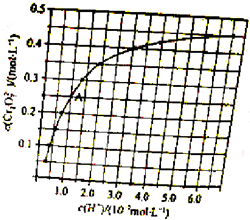 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)[与偏铝酸根相似,偏铝酸根也可以写成Al(OH)4-]Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)[与偏铝酸根相似,偏铝酸根也可以写成Al(OH)4-]Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:科目:gzhx 来源: 题型:
| H+ |
| ①转化 |
| 光照,草酸溶液 |
| ②还原 |
| OH- |
| ③沉淀 |
| 实验编号 | 初始PH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| 甲 | 4 | 60 | 10 | 30 |
| 乙 | 5 | 10 | 30 | |
| 丙 | 5 | 5 |

科目:czhx 来源:2009年广东省茂名市中考化学试题 题型:022
铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上.铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因.请回答下列问题:
(1)铁生锈的主要条件是铁与________和________直接接触.
(2)不锈钢是一种________(填“合金”或“金属”).
(3)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:

①上述三种金属的活动性由强到弱的顺序是________.
②从上述探究实验可知,Cr________(填“能”或“不能”)跟CuSO4溶液反应.若反应,请写出反应的化学方程式________.
科目:czhx 来源: 题型:
铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1)铁生锈的主要条件是铁与________和________直接接触。
(2)不锈钢是一种____________(选填“合金”或“金属”)。
(3)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
| 金属 | Cr | Mg | Cu |
| 与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 | 无明显现象 |
①上述三种金属的活动性由强到弱的顺序是__________________。
②从上述探究实验可知,Cr(选填“能”或“不能”)跟CuSO4溶液反应。若反应,请写出反应的化学方程式______________________________。
科目:czhx 来源:同步题 题型:填空题

科目:czhx 来源: 题型:
铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1)铁生锈的主要条件是铁与________和________直接接触。
(2)不锈钢是一种____________(填“合金”或“金属”)。
(3)相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
| 金属 | Cr | Mg | Cu |
| 与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 | 无明显现象 |
①上述三种金属的活动性由强到弱的顺序是__________________。
②从上述探究实验可知,Cr(填“能”或“不能”)跟CuSO4溶液反应。若反应,请写出反应的化学方程式______________________________。
科目:czhx 来源:2013届江苏省苏州市吴中区B组共同体九年级12月月考化学试卷(带解析) 题型:填空题
(7分)铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1) 铁生锈的主要条件是铁与________和________直接接触。
(2) 不锈钢是一种____________(填“合金”或“金属”)。
(3) 相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
| 金属 | Cr | Mg | Cu |
| 与盐酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 | 无明显现象 |
科目:czhx 来源:2012-2013学年江苏省苏州市区B组共同体九年级12月月考化学试卷(解析版) 题型:填空题
(7分)铬(Cr)为不锈钢主要的添加元素,含量一般在12%以上。铬的表面生成一薄层致密的钝态氧化物保护膜是不锈钢具有耐蚀性主要原因。请回答下列问题:
(1) 铁生锈的主要条件是铁与________和________直接接触。
(2) 不锈钢是一种____________(填“合金”或“金属”)。
(3) 相同温度下,取大小相同、表面光亮的Cr、Mg、Cu三种金属薄片,分别投入等体积等溶质质量分数的足量稀盐酸中(反应中Cr显+2价),现象如下:
|
金属 |
Cr |
Mg |
Cu |
|
与盐酸反应现象 |
放出气泡速率缓慢 |
放出气泡速率较快 |
无明显现象 |
① 上述三种金属的活动性由强到弱的顺序是__________________。
② 从上述探究实验可知,Cr ______(填“能”或“不能”)跟硫酸铜溶液反应。若反应,请写出反应的化学方程式______________________ ________。