铬是广泛存在于环境中的重金属元素,在水体中主要以三价和六价铬的化合物为主.含六价铬的酸性工业废水,通常的处理流程为:
CrO
42-Cr
2O
72-Cr
3+Cr(OH)
3↓
完成下列问题:
(1)第①步存在平衡:2CrO
42-(黄色)+2H
+?Cr
2O
72-(橙色)+H
2O,写出该反应的平衡常数表达式,K=
,若平衡体系的pH=2,则溶液显
色,下列能说明第①步反应达平衡状态的是
;
a.Cr
2O
72-和CrO
42-的浓度相同 b.2v(Cr
2O
72-)=v(CrO
42-) c.溶液的颜色不变
(2)为进一步研究初始pH和草酸浓度对第②步反应速率的影响,作对比实验如表:
| 实验编号 |
初始PH |
废水样品体积/mL |
草酸溶液体积/mL |
蒸馏水体积/mL |
| 甲 |
4 |
60 |
10 |
30 |
| 乙 |
5 |
|
10 |
30 |
| 丙 |
5 |
|
5 |
|
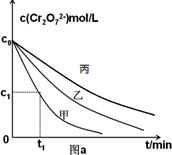
①完成实验设计表(表中不要留空格);在图a上画出实验丙中Cr
2O
72-的浓度变化曲线.
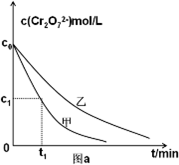
②测得实验甲和乙溶液中的Cr
2O
72-浓度随时间变化关系如图a所示,则实验甲和乙的结果表明
;实验甲中0~t
1时间段反应速率v(Cr
3+)=
mol/(L?min) (用含字母的代数式表示);
(3)第③步生成的Cr(OH)
3在溶液中存在以下沉淀溶解平衡:Cr(OH)
3(s)?Cr
3+(aq)+3OH
-(aq),常温下,溶度积Ksp[Cr(OH)
3]=1×10
-32,要使c(Cr
3+)不高于10
-5mol/L,溶液的pH应调至
.


 ,故答案为:
,故答案为: ;
;

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案

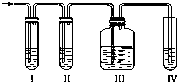 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.