


科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溴水中通入SO2气体 | 溶液褪色 | SO2具有漂白性 |
| B | 向淀粉水解液中加入NaOH溶液至碱性,再加入新制Cu(OH)2,煮沸 | 有砖红色沉淀生成 | 淀粉已水解 |
| C | 向某钠盐X的溶液中先滴加稀盐酸,无现象,再滴加BaCl2溶液 | 出现白色沉淀 | X一定是Na2SO4 |
| D | BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaSO4)>Ksp(BaCO3) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁片投入到冷的浓硫酸中,铁片失去电子数为0.3NA |
| B、16g CH4中含有4NA个C-H键 |
| C、标准状况下,3g NO与1.6g O2混合气体所含有的分子数为0.1NA |
| D、标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
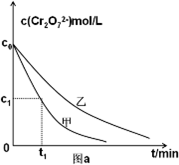
| H+ |
| ①转化 |
| 光照,草酸溶液 |
| ②还原 |
| OH- |
| ③沉淀 |
| 实验编号 | 初始PH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| 甲 | 4 | 60 | 10 | 30 |
| 乙 | 5 | 10 | 30 | |
| 丙 | 5 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [c(C)]c?[c(D)]d |
| [c(A)]a?[c(B)]b |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
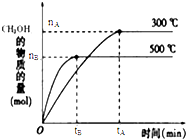 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com