
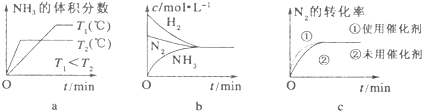
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |
| 2x |
| 1-x+3-3x+2x |
| 1 |
| 3 |
(
| ||||
(1-
|
| 1 |
| 12 |
| 1 |
| 12 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| B、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
| C、白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2 L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、0.1mol/L的FeCl3溶液所含Cl-数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类将要面临的一个重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
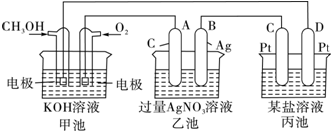
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com