
| A、常温常压下,11.2 L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、0.1mol/L的FeCl3溶液所含Cl-数目为0.3NA |
| m |
| M |
| m |
| M |
| m |
| M |
| 1.8g |
| 18g/mol |
| m |
| M |
| 48g |
| 48g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过电解法获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
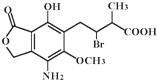 某有机物A的结构简式如图,下列有关A的说法正确的是( )
某有机物A的结构简式如图,下列有关A的说法正确的是( )| A、分子式为:C14H25O6NBr |
| B、该有机物能发生水解反应,但不能发生消去反应 |
| C、该有机物能使酸性高锰酸钾溶液褪色 |
| D、A在一定条件下与氢氧化钠溶液反应,1 molA最多消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu(Fe)--加盐酸,过滤 |
| B、乙醇(水)--加生石灰,蒸馏 |
| C、KNO3溶液(KCl)--降温结晶,过滤 |
| D、CO2(HCl)--饱和NaOH溶液,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁片投入到冷的浓硫酸中,铁片失去电子数为0.3NA |
| B、16g CH4中含有4NA个C-H键 |
| C、标准状况下,3g NO与1.6g O2混合气体所含有的分子数为0.1NA |
| D、标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液溶胶是一种液态混合物属于分散系的一种 |
| B、直径介于1 nm~10 nm之间的微粒称为胶体 |
| C、胶体的本质特征是发生丁达尔效应 |
| D、用过滤器可以将胶体和溶液分开 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| 光照,草酸溶液 |
| ②还原 |
| OH- |
| ③沉淀 |
| 实验编号 | 初始PH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| 甲 | 4 | 60 | 10 | 30 |
| 乙 | 5 | 10 | 30 | |
| 丙 | 5 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
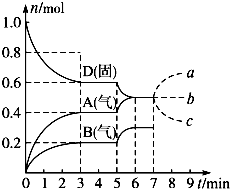 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:| 9 |
| 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com