
科目:gzhx 来源:福建省上杭一中2010-2011学年高二下学期期中考试化学试题 题型:022
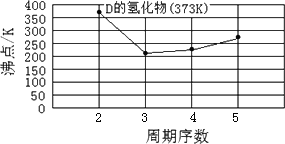
A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大.A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;E与F同周期,E的第一电离能高于F;G与F同主族.请回答下列问题:
(1)写出G元素基态原子的核外电子排布式________;
(2)B、C、D三种元素第一电离能由大到小的顺序是________(用元素符号表示);
(3)下列有关上述元素的说法,正确的是________(填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于分子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为________,14 g B2A4分子中含有________molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似.ED的熔点比NaCl高,其原因是________.
科目:gzhx 来源:2015-2016学年江苏省盐城市高二下学期期中考试化学试卷(解析版) 题型:填空题
A、B、C、D、E、F、G七种短周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是内层电子数的3倍;D与G处在同一族;F是地壳中含量最高的金属元素。请回答下列问题:
(1)元素F在周期表中的位置 。
(2)B、C、D三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于 (填晶体类型)。
(4)CA3分子的电子式为 。
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
(6)由A、D、G中任两种元素构成甲、乙两种均含18个电子的分子,所含原子的数目依次为3、4。则甲分子的中心原子采取 杂化;1 mol乙分子含有 molσ键。
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:解答题
 E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大.E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态.请回答下列问题:
E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大.E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态.请回答下列问题:科目:gzhx 来源: 题型:解答题
 .
.科目:gzhx 来源: 题型:阅读理解
(12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素电负性由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,1 mol B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
说明:O摄氏度=273K
【解析】原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C、D、E、F、G的原子序数依次增大,所以C是N。
(1)Al的原子序数是13,所以基态原子的核外电子排布式1S22S22P63S23P1。
(2)电负性是用来描述不同元素的原子对键合电子吸引了的大小,非金属性越强,电负性越大。C、N、O均属于同一周期元素,原子序数逐渐增大,所以非金属性逐渐增强,即电负性大小顺序为O > N > C
(3)氨气中含有氢键所以其沸点高于甲烷的,①不正确。CCl4、苯等有机溶剂均属于非极性分子,根据相似相溶原理可判断Ni(CO)4应为分子晶体,②不正确。氨气分子中的中心原子有4对电子对,其中有1对孤电子对,所以空间构型是三角锥形,采用sp3杂化,③不正确。镁合铝是金属,形成的是金属晶体,金属原子半径越小,金属离子的电荷数越多,金属键越强,所以④正确。比G的原子序数少1的元素是锌,由于锌的核外电子均是全充满,稳定,所以其第一电离能要大于Ga,⑤正确。
(4)在CH2=CH2中含有4个C-H单键和1个碳碳双键,而双键又是又1个σ键和1个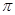 键构成的,所以1mol乙烯中含有5molσ键。
键构成的,所以1mol乙烯中含有5molσ键。
(5)氧化镁和氯化钠均属于离子晶体,形成离子晶体的离子键越强,熔点越高。形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,镁离子半径小于钠离子半径氧离子半径小于氯离子半径,所以氧化镁的熔点高于氯化钠的。
科目:gzhx 来源:2011-2012年福建漳州芗城中学高二下学期期中考试理科化学试卷(解析版) 题型:填空题
(12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素电负性由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,1 mol B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
说明:O摄氏度=273K
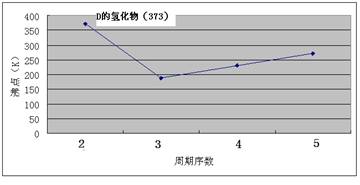
【解析】原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C、D、E、F、G的原子序数依次增大,所以C是N。
(1)Al的原子序数是13,所以基态原子的核外电子排布式1S22S22P63S23P1。
(2)电负性是用来描述不同元素的原子对键合电子吸引了的大小,非金属性越强,电负性越大。C、N、O均属于同一周期元素,原子序数逐渐增大,所以非金属性逐渐增强,即电负性大小顺序为O > N > C
(3)氨气中含有氢键所以其沸点高于甲烷的,①不正确。CCl4、苯等有机溶剂均属于非极性分子,根据相似相溶原理可判断Ni(CO)4应为分子晶体,②不正确。氨气分子中的中心原子有4对电子对,其中有1对孤电子对,所以空间构型是三角锥形,采用sp3杂化,③不正确。镁合铝是金属,形成的是金属晶体,金属原子半径越小,金属离子的电荷数越多,金属键越强,所以④正确。比G的原子序数少1的元素是锌,由于锌的核外电子均是全充满,稳定,所以其第一电离能要大于Ga,⑤正确。
(4)在CH2=CH2中含有4个C-H单键和1个碳碳双键,而双键又是又1个σ键和1个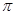 键构成的,所以1mol乙烯中含有5molσ键。
键构成的,所以1mol乙烯中含有5molσ键。
(5)氧化镁和氯化钠均属于离子晶体,形成离子晶体的离子键越强,熔点越高。形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,镁离子半径小于钠离子半径氧离子半径小于氯离子半径,所以氧化镁的熔点高于氯化钠的。
科目:gzhx 来源:不详 题型:填空题

科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:解答题
 现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题:
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大.A的原子半径最小;B的原子有6个运动状态不同的电子;D、E两元素同主族,且E的原子核外电子数是D的2倍;F是前四周期中未成对电子数最多的元素;G原子内层轨道全排满电子,最外层电子数为2.根据以上信息,回答下列问题: ;
;科目:gzhx 来源: 题型:
科目:gzhx 来源:2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷(带解析) 题型:填空题
(1)按要求填空:电负性最大的元素符号 ______;第一电离能最大的元素基态原子核外电子排布式_________;第三周期原子半径最小的元素的价电子排布式______。
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是 ;只含有极性键的是 ;只含有离子键的是 ;既含有非极性键又含有极性键的是 ;含有非极性键的离子化合物是 。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的 键更稳定(填“σ”或“π”)。
科目:gzhx 来源:2014届山东省淄博市高二下学期期中模块检测化学卷(解析版) 题型:填空题
(1)按要求填空:电负性最大的元素符号 ______;第一电离能最大的元素基态原子核外电子排布式_________;第三周期原子半径最小的元素的价电子排布式______。
(2)在下列物质中:①N2、②H2O、③NaOH、④MgCl2、⑤C2H4、⑥Na2O2(用序号填空)
其中只含有非极性键的是 ;只含有极性键的是 ;只含有离子键的是 ;既含有非极性键又含有极性键的是 ;含有非极性键的离子化合物是 。
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的 键更稳定(填“σ”或“π”)。
科目:gzhx 来源: 题型:填空题
科目:gzhx 来源:不详 题型:填空题
科目:gzhx 来源:2013-2014学年吉林省吉林市高三上学期期末复习检测化学试卷(解析版) 题型:填空题
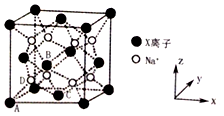
有位于周期表前四周期的A、B、C、D、E、F六种元素,其原子序数依次增大。已知A原子核外有三个未成对电子;A与B形成的一种化合物常温下是红棕色气体;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;F原子核外最外层电子数与C相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D四种原子的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)C的氯化物的熔点比D的氯化物的熔点 (填“高”或“低”),理由是 。
(3)E的最高价氧化物分子的空间构型是 。
(4)基态F+离子的核外电子排布式是 ,F的高价离子与A的最常见氢化物形成的配离子的化学式为 。
(5)Q分子是A2B的等电子体,Q的结构式为 ,Q分子的中心原子的杂化类型是 。
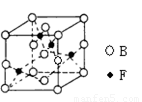
(6)下图是B、F两元素组成的一种化合物的晶胞,其化学式为 。
科目:gzhx 来源:不详 题型:填空题

科目:gzhx 来源: 题型:
 有位于周期表前四周期的A、B、C、D、E、F六种元素,其原子序数依次增大.已知A原子核外有三个未成对电子;A与B形成的一种化合物常温下是红棕色气体;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;F原子核外最外层电子数与C相同,其余各层均充满.请根据以上信息,回答下列问题:
有位于周期表前四周期的A、B、C、D、E、F六种元素,其原子序数依次增大.已知A原子核外有三个未成对电子;A与B形成的一种化合物常温下是红棕色气体;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;F原子核外最外层电子数与C相同,其余各层均充满.请根据以上信息,回答下列问题:科目:gzhx 来源: 题型:解答题
 ;该化合物中Y的杂化轨道类型是sp3.
;该化合物中Y的杂化轨道类型是sp3.