
科目:gzhx 来源: 题型:022
已知热化学方程式H+(aq)+OH-(aq)═H2O(l),DH=-57.3kJ/mol,问:
(1)常量滴定用0.025L 0.10mol/L的一元强酸和一元强碱互相中和,则滴定过程中释放的热量为________kJ;
(2)若中和后溶液体积为0.05L,又已知中和后的溶液的热容量为4.2´10-3kJ/(g•℃),且密度为1.0g/mL,则溶液温度升高________℃;
(3)由(2)说明为什么需要用1mol/L~2mol/L的强酸和强碱反应测定中和热?
_____________________________________________________________________________。
科目:gzhx 来源:物理教研室 题型:022
已知热化学方程式![]() ;酸碱中和反应中每生成1mol水放出57.3kJ的热量,问:
;酸碱中和反应中每生成1mol水放出57.3kJ的热量,问:
(1)常量滴定用0.025L0.10mol/L的强酸和强碱互相中和,则滴定过程中释放的热量为________kJ.
(2)若中和后溶液体积为0.05L,又已知中和后的溶液的热容量为![]() ,且密度为1.0g/mL,则溶液温度升高________℃.
,且密度为1.0g/mL,则溶液温度升高________℃.
科目:gzhx 来源:物理教研室 题型:022
(1)常量滴定用0.025L 0.10mol/L的一元强酸和一元强碱互相中和,则滴定过程中释放的热量为________kJ;
(2)若中和后溶液体积为0.05L,又已知中和后的溶液的热容量为4.2´10-3kJ/(g•℃),且密度为1.0g/mL,则溶液温度升高________℃;
(3)由(2)说明为什么需要用1mol/L~2mol/L的强酸和强碱反应测定中和热?
_____________________________________________________________________________。
科目:gzhx 来源:宁夏中卫市海原一中2011-2012学年高二第一学段考试化学试题 题型:058
实验室用0.1000 mol/L的NaOH溶液滴定0.1 mol/L左右的盐酸,按要求完成下列列问题:
(1)实验用品有________、________、________、________、________、________、________、________、________、________.
(2)实验步骤:①查:查________、查________、查________.
②盛:润洗滴定管,取液________ml,洗________次.润洗了锥形瓶滴定结果会使盐酸的浓度________(填“偏高”“偏低”或“不变”).
③滴:滴定操作中左手________,右手________,眼睛________.
④判:你选用________做指示剂,滴定终点显________色.终点溶液呈________性.
⑤算:滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数,滴定结果会使盐酸的浓度________(填“偏高”“偏低”或“不变”).滴定管能精确到________ml.室温下给锥形瓶中量取20.00 ml盐酸,加入指指示剂,用NaOH溶液平行做了三次滴定实验,三次NaOH溶液体积分别为21.45 ml,21.47 ml,23.14 ml,试计算盐酸的浓度是________.
科目:gzhx 来源:浙江省期末题 题型:单选题
科目:gzhx 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
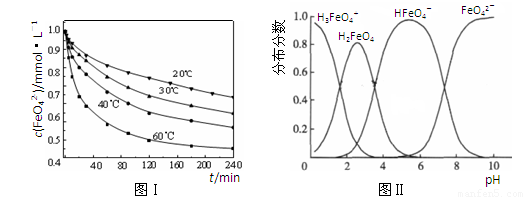
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
科目:gzhx 来源: 题型:阅读理解
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4)y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:
(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
科目:gzhx 来源: 题型:阅读理解
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4)y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:
(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
科目:gzhx 来源: 题型:阅读理解
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4)y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:
(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
科目:gzhx 来源:2011-2012学年浙江省杭州第二中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:
(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
科目:gzhx 来源:2011-2012学年高三上学期化学一轮复习《化学家眼中的物质世界》专题综合测试(苏教版) 题型:填空题
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O

材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
科目:gzhx 来源:2010年山东省潍坊市高三上学期开学摸底考试化学试题 题型:填空题
(13分)材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
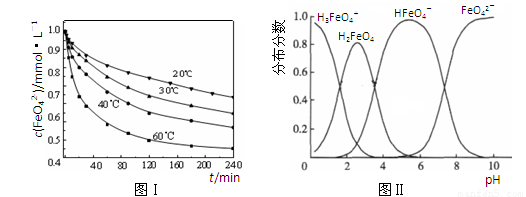
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是 。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
科目:gzhx 来源: 题型:阅读理解
材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
 |
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。

I.制备:
(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是
。
(5)操作Ⅲ的名称是 。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 。两个滴定中到达终点时溶液颜色为 色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式 。
科目:gzhx 来源:湖南省岳阳县一中2010-2011学年高三第一次阶段考试化学 题型:单选题
在化学实验室进行下列实验操作时,其操作或记录的数据正确的是 ( )
A.用托盘天平称取8.84g食
B.用250mL的容量瓶配制所需的280mL、0.10mol/L的NaOH溶液
C.用量筒量取12.12mL的盐酸
D.用0.12mol/L盐酸滴定未知浓度的NaOH溶液,消耗盐酸21.40mL
科目:gzhx 来源: 题型:阅读理解
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
科目:gzhx 来源:2014届云南省昆明市高二9月月考化学试卷(解析版) 题型:实验题
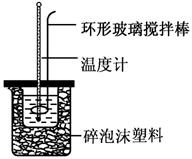
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
|
实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是 。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH= [盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、 “不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大
科目:gzhx 来源:2013-2014学年贵州省遵义市高三第二次联考理综化学试卷(解析版) 题型:实验题
在实验室测定碳酸钠与碳酸氢钠的混合物中,碳酸钠的质量分数[用符号w(Na2CO3)表示],称取此混合物5.lg,溶于水中,配成250mL溶液。
a.(10分)方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是___________ (填编号)。
A.CaCl2 B.MgSO4 C. .NaCI D.Ba(OH)2
(2)简述证明HCO3-、CO32-已完全沉淀的实验操作_________________________。
(3)过滤,提取沉淀,则过滤操作所需要的玻璃仪器有________________________。
(4)洗涤沉淀,简述洗涤沉淀的操作_____________________________。
(5)干燥充分,称取沉淀的质量为9.8g,由此计算w(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)________________(填偏大或偏小、无影响)。
b.方案二:滴定法测w(Na2CO3)量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸进行滴定到终点。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。 [已知饱和的碳酸溶液PH为3.9]
(1)量取25.00 mL配制好的溶液,应选择_______________仪器来完成。
(2)判断滴定终点的依据是_____________________,此过程中反应的离子方程式为__________________________________________________。
(3)此法测得w(Na2CO3)=________%(保留两位小数)
科目:gzhx 来源:2010年浙江省高二第二学期期中考试(1-3班)化学试题 题型:填空题
(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
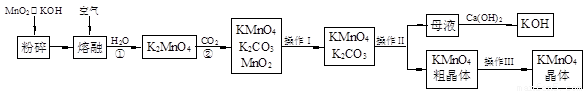
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
|
滴定次数[来源:][来源:Z&xx&k.Com] |
待测溶液的体积/mL[来源:学#科#网Z#X#X#K] |
标准溶液的体积[来源:] |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 mL |
0.02 |
24.01 |
|
2 |
25.00 mL |
0.70 |
24.71 |
|
3 |
25.00 mL |
0.20 |
24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为 。
科目:gzhx 来源:2014届湖北省高二秋季期中联考化学试卷(解析版) 题型:阅读理解
(14分)酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。
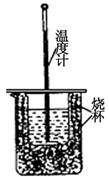
①从实验装置上看,图中尚缺少的一种玻璃仪器是 。
②大小烧杯之间填满纸屑的作用是 。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值 (填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:
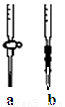
①应选择 滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化, 即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
|
实验次数 |
起始滴定管读数 |
终点滴定管读数 |
|
1 |
0.00mL |
24.02mL |
|
2 |
0.50mL |
24.46mL |
|
3 |
2.50mL |
25.02mL |
测得未知稀盐酸的物质的量浓度为 (保留小数点后3位)。
⑤以下操作造成测定结果偏高的原因可能是 (填写字母序号)。
A. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 未用标准液润洗碱式滴定管
E. 滴定前锥形瓶用蒸馏水洗净后未干燥
科目:gzhx 来源:2012-2013学年云南省昆明市官渡区二中高二9月月考化学试卷(带解析) 题型:实验题
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据: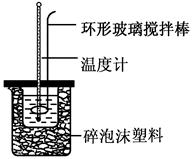
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |