
科目:gzhx 来源:新课程同步学案专家伴读 化学选修4(化学反应原理) 鲁科版 鲁科版 题型:022
电极产物判断.
(1)阳极产物的判断:首先看电极,如果是活泼电极,则电极材料失电子,如果是惰性电极(用石墨、金、铂等还原性较弱的材料制作的电极),则溶液中的阴离子失去电子,常见阴离子放电顺序为:________________.
(2)常见阳离子放电顺序为:________________.
科目:gzhx 来源: 题型:
关于下列室温下的溶液的一些说法中,完全正确的是
①pH=4 FeCl3溶液;②pH=10 Na2CO3溶液;③pH=2 HCl溶液;④pH=3 CH3COOH溶液;⑤pH=11 NaOH溶液;⑥pH=3 NH4Cl溶液
A.水的电离程度:①=②、③<④、⑤=⑥
B.④、⑤溶液等体积混合后所得溶液中水的电离程度大于纯水的电离程度
C.⑤、⑥溶液等体积混合后所得溶液中离子浓度顺序是c(Cl—)>c(NH4+)>c(OH—)>c(H+)
D.②溶液中:c(H+)+c(H2CO3)+c(HCO3—)=c(OH—)
科目:gzhx 来源:2010年海南省高三五校联考化学试题 题型:填空题
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
| A.基态原子中不一定都有未成对的电子 |
| B.由极性键形成的分子一定是极性分子 |
| C.晶格能大小顺序:NaCl > KCl |
| D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子 |
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
科目:gzhx 来源:2010年海南省高三五校联考化学试题 题型:填空题
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
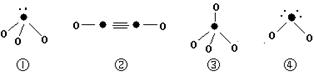
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
科目:gzhx 来源: 题型:阅读理解
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
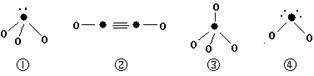
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
科目:gzhx 来源: 题型:阅读理解
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
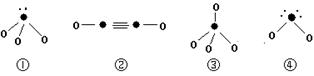
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
科目:gzhx 来源: 题型:


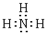
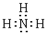
科目:gzhx 来源: 题型:
(分)已知五种元素为短周期元素,其原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称A________,B________,C________,D________,E________;
(2)用电子式表示A2C的形成过程________________________________;
(3)D与E形成常见离子的空间构型为________________;
(4)A、B两元素形成的化合物A2B2属于__________晶体(填类型),晶体内存在的化
学键有___________;A2B晶体的熔点_______(填“>”“=”“<”)A2C晶体的熔点;
(5)由A、B、C、E四种元素,可以共同形成两种不同化合物,它们的水溶液可以反应
生成一种气体,请写出离子方程式:___________________________________。
科目:gzhx 来源:2012-2013学年四川省成都高新区高三9月统一检测化学试卷(解析版) 题型:填空题
(13分) 下表为元素周期表的一部分,其中编号代表对应的元素。

请回答下列问题:
(1)写出元素⑦的基态原子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素④和⑥的第一电离能大小顺序是 > (用元素符号表示)。请写出由④和⑤两种元素形成的与N3-互为等电子体的离子的化学式 ,其VSEPR构型为 。
(4)在测定①和⑥形成的化合物的相对分子质量时,实验测得值一般高于理论值,其主要原因是 。
(5)④和⑧形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中④显-3价),则其化学式为 。
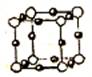
⑧的常见离子和④的最简单氢化物形成的配离子的名称为 ,
其水溶液颜色为 。
科目:gzhx 来源:2010年浙江省高一第二学期期中考试(8-12班)化学试题 题型:选择题
A、B、C、D都是短周期元素,原子半径:D>C >A >B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是
A.B、C、D三种元素组成的化合物的化学式为D2CB2
 B.A、C两元素处在元素周期表中的第ⅥA族
B.A、C两元素处在元素周期表中的第ⅥA族
C.B、C、D三种元素的简单离子的半径大小顺序为:C > D > B
 D.B、D两元素可形成两种离子化合物,其阴、阳离子数之比均为1∶2
D.B、D两元素可形成两种离子化合物,其阴、阳离子数之比均为1∶2
科目:gzhx 来源:福建省2010-2011学年高三第一次月考化学试题 题型:选择题
A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是 ( )
A.A、C两元素处在元素周期表中的第ⅥA族[来源:ZXXK]
B.C、D两种元素的最高价氧化物的水化物相互能够反应生成一种强电解质
C.B、D两元素组成的化合物中阴、阳离子的个数比为1∶1
D.B、C、D三种元素的简单离子的半径大小顺序为:C > D > B
科目:gzhx 来源:2013届安徽省高三上学期开学水平检测考试化学试卷(解析版) 题型:填空题
(13分)短周期元素A、B、C、D、E的原子序数依次增大, A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)写出D元素的基态原子电子排布式 。C、D、E的简单离子半径由小到大的顺序 ( 用离子符号表示)。
(2)工业上常用A和B的单质合成一种常见气体,该气体的电子式 。
检验该气体的常用方法是 。
(3)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。
(4)A、B、C三种元素可组成一种常见离子化合物,其水溶液呈酸性,该溶液中离子浓度由大到小的顺序是 。
(5)电动汽车的某种燃料电池,通常用NaOH作电解质,用E单质、石墨作电极,在石墨电极一侧通入空气,该电池的正极反应: 。
科目:gzhx 来源:2013届安徽省怀宁中学高三上学期开学水平检测考试化学试卷(带解析) 题型:填空题
(13分)短周期元素A、B、C、D、E的原子序数依次增大, A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)写出D元素的基态原子电子排布式 。C、D、E的简单离子半径由小到大的顺序 (用离子符号表示)。
(2)工业上常用A和B的单质合成一种常见气体,该气体的电子式 。
检验该气体的常用方法是 。
(3)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。
(4)A、B、C三种元素可组成一种常见离子化合物,其水溶液呈酸性,该溶液中离子浓度由大到小的顺序是 。
(5)电动汽车的某种燃料电池,通常用NaOH作电解质,用E单质、石墨作电极,在石墨电极一侧通入空气,该电池的正极反应: 。
科目:gzhx 来源:2010-2011学年广东省清远市清城区高三第一次模拟考试(理综)化学部分 题型:填空题
短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是: > > (填写离子符号)[来源:Zxxk.Com]
(2)指出元素D在元素周期表中的位置:__________________________。
(3)元素B的氧化物属于 化合物(填“离子”或“共价”),其电子式为 。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为 。
(5)含有C阳离子的盐常用来净化水,其原因为
。
(用离子方程式表示和适当的文字说明)
科目:gzhx 来源:2013-2014学年陕西省高三下学期第一次联考理综化学试卷(解析版) 题型:填空题
四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C三种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物。回答下列问题:
(1)已知A元素与氢元素形成的某种气态化合物在标准状况下的密度为1.161g/L,则在该化合物的分子中A原子的杂化方式为 。
(2)A、B、C二种元素的第一电离能由小到大的顺序为 (填元素符号)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5……,推测D元素的电离能第一次突增应出现在第___电离能。
(4)AC2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于______________晶体.该晶体中A原子轨道的杂化类型为 。
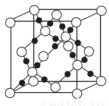
(5)C和C形成原子个数比为1:3的常见离子.推测这两种微粒的空间构型为 。
(6)C和D形成的一种离子化合物D2C的晶胞结构如图所示.该晶体中阳离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。

已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA.则晶胞边长a= cm(用含ρ、NA的代数式表示)。
科目:gzhx 来源: 题型:
短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是: > > (填写离子符号)
(2)指出元素D在元素周期表中的位置:__________________________。
(3)元素B的氧化物属于 化合物(填“离子”或“共价”),其电子式为 。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为 。
(5)含有C阳离子的盐常用来净化水,其原因为
。
(用离子方程式表示和适当的文字说明)
科目:gzhx 来源:2012-2013学年河北省石家庄市毕业班第二次模拟考试理综化学试卷(解析版) 题型:填空题
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
|
阳离子 |
Na+、Al3+、Ba2+、H+、NH4+ |
|
阴离子 |
SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______ (填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______ (填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为____________________
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。
科目:gzhx 来源:2011-2012学年福建省高三上学期第一次月考化学试卷 题型:选择题
A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是 ( )
A.A、C两元素处在元素周期表中的第ⅥA族
B.C、D两种元素的最高价氧化物的水化物相互能够反应生成一种强电解质
C.B、D两元素组成的化合物中阴、阳离子的个数比为1∶1
D.B、C、D三种元素的简单离子的半径大小顺序为:C > D > B
科目:gzhx 来源: 题型:
短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是: > > (填写离子符号)
(2)指出元素D在元素周期表中的位置:__________________________。
(3)元素B的氧化物属于 化合物(填“离子”或“共价”),其电子式为 。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为 。
(5)含有C阳离子的盐常用来净化水,其原因为
。
(用离子方程式表示和适当的文字说明)
科目:gzhx 来源:2011届广东省清远市清城区高三第一次模拟考试(理综)化学部分 题型:填空题
短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化 物之间两两皆能反应,均生成盐和水。请完成下列各小题:
物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是: > > (填写离子符号)
(2)指出元素D在元素周期表中的位置:__________________________。
(3)元素B的氧化物属于 化合物(填“离子”或“共价”),其电子式为 。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为 。
(5)含有C阳离子的盐常用来净化水,其原因为
。
(用离子方程式表示和适当的文字说明)