
科目:gzhx 来源: 题型:
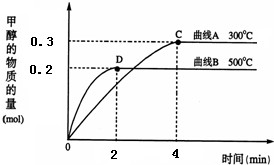 在体积为2L的密闭容器中,CO与H2在一定条件下反应生成甲醇:
在体积为2L的密闭容器中,CO与H2在一定条件下反应生成甲醇: CH3OH(g).反应达到平衡时,平衡常数表达式K=
CH3OH(g).反应达到平衡时,平衡常数表达式K=| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
科目:gzhx 来源: 题型:阅读理解
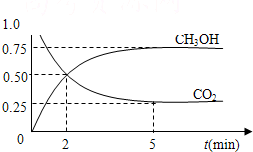 (2011•天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.
(2011•天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH- Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动 Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动科目:gzhx 来源: 题型:阅读理解
 2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.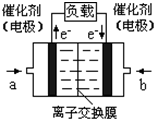 意图,则a处通入的是
意图,则a处通入的是科目:gzhx 来源: 题型:
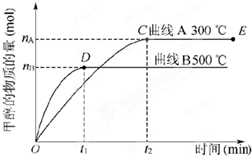 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)2H2(g)⇌CH3OH(g),甲醇生成量与时间的关系如图所示.下列有关说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)2H2(g)⇌CH3OH(g),甲醇生成量与时间的关系如图所示.下列有关说法正确的是( )科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:阅读理解
 (2012•信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012•信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
科目:gzhx 来源: 题型:
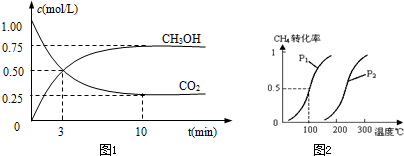
| c(CO)•c3(H2) |
| c(CH4)•c(H2O) |
| c(CO)•c3(H2) |
| c(CH4)•c(H2O) |
科目:gzhx 来源: 题型:
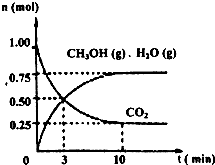
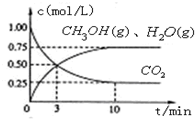
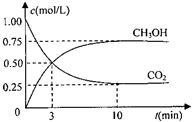
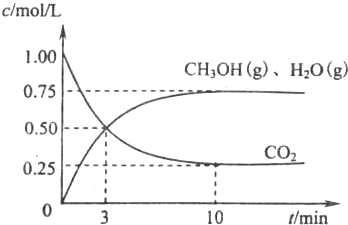
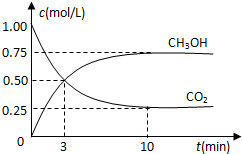
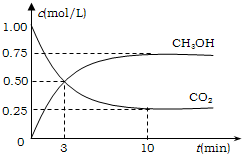 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.科目:gzhx 来源: 题型:
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)科目:gzhx 来源: 题型:
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g).根据题意完成下列问题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g).根据题意完成下列问题:| c(CH3OH) |
| c(CO)•C 2(H2) |
| c(CH3OH) |
| c(CO)•C 2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2科目:gzhx 来源: 题型:
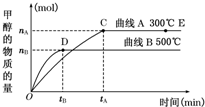 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题:| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
科目:gzhx 来源: 题型:阅读理解
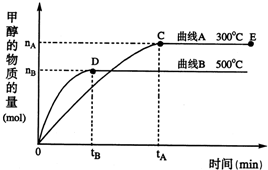 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): CH3OH(g)
CH3OH(g)| c(CH3OH) |
| c(CO)•c2(H2) |
| c(CH3OH) |
| c(CO)•c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2| 点燃 |
| 点燃 |

科目:gzhx 来源: 题型:
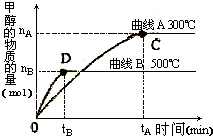 (1)在体积为3L的密闭容器中加入一定量的CO与H2,它们在一定条件下反应生成甲醇:CO(g)+2H2(g)→CH3OH(g).不同温度条件下,反应从开始到平衡,甲醇的物质的量变化如图所示,则该反应是
(1)在体积为3L的密闭容器中加入一定量的CO与H2,它们在一定条件下反应生成甲醇:CO(g)+2H2(g)→CH3OH(g).不同温度条件下,反应从开始到平衡,甲醇的物质的量变化如图所示,则该反应是科目:gzhx 来源: 题型:
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g)| c(CH3OH) |
| c(CO)•c2(H2) |
| c(CH3OH) |
| c(CO)•c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |
科目:gzhx 来源: 题型:阅读理解
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
科目:gzhx 来源: 题型:
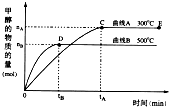 一定条件下,在体积为3L的密闭容器中,通入一定物质的量的CO和H2,发生如下反应:CO(g)+2H2(g)⇌CH3OH(g),在不同温度下测得甲醇的物质的量随时间的变化如图所示.下列叙述不正确的是( )
一定条件下,在体积为3L的密闭容器中,通入一定物质的量的CO和H2,发生如下反应:CO(g)+2H2(g)⇌CH3OH(g),在不同温度下测得甲醇的物质的量随时间的变化如图所示.下列叙述不正确的是( )科目:gzhx 来源: 题型:
| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
科目:gzhx 来源: 题型:
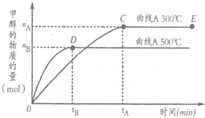 (2011•巢湖二模)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇的反应(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(2011•巢湖二模)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇的反应(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),结合右图判断下列说法正确的是( )
CH3OH(g),结合右图判断下列说法正确的是( )科目:gzhx 来源: 题型:
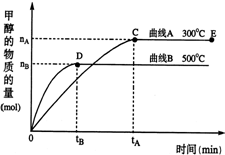 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)⇌CH3OH(g)| c(CH3OH) |
| c(CO)•C2(H2) |
| c(CH3OH) |
| c(CO)•C2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| 1 |
| 2 |