
题目列表(包括答案和解析)
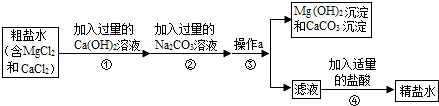
(8分)“海水晒盐”所获得的粗盐中,除含有泥沙等难溶性杂质外,还含有氯化镁、氯化钙等可溶性杂质,某化学小组为得到较纯净的食盐,进行了下列实验探究活动,请参与他们的探究活动。
[提出问题]如何获得较纯的食盐晶体?
[查阅资料]
20℃时,部分物质的溶解性
情况如下表所示:
| | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |

海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4等物质,如图是它们的溶解度曲线,完成下列填空。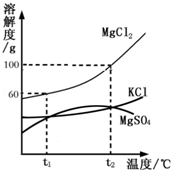
(1)在t1℃时,向100g水中加入150g MgCl2,形成 (填“饱和”或“不饱和”)溶液,将其温度升高到t2℃时,此时溶液中溶质的质量分数为 。
(2)t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是 。将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,可能会析出的晶体有 (填字母序号)。
A.MgCl2和KCl B.只有MgSO4 C.MgCl2、KCl和MgSO4
(8分)“海水晒盐”所获得的粗盐中,除含有泥沙等难溶性杂质外,还含有氯化镁、氯化钙等可溶性杂质,某化学小组为得到较纯净的食盐,进行了下列实验探究活动,请参与他们的探究活动。
[提出问题]如何获得较纯的食盐晶体?
[查阅资料]
20℃时,部分物质的溶解性
情况如下表所示:
| OH- | CO32- |
Na+ | 溶 | 溶 |
Ca2+ | 微 | 不 |
Mg2+ | 不 | 微 |
[实验方案]按如下方案进行提纯粗盐。
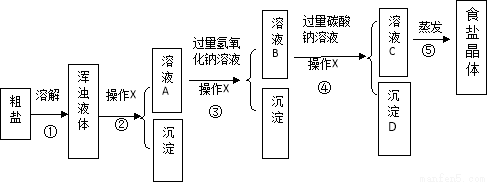
[解释与结论]
(1)实验操作X的名称是 ;沉淀D是 。
(2)为达到除去难溶性杂质的实验步骤是 。(填序号)
(3)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 。
(4)在进行实验步骤⑤的蒸发时,为防止液体飞溅和获得相对更纯的食盐晶体需要进行的操作是 。
[反思与评价]
(5)有同学认为该实验方案并不完善,其理由及需补充的实验操作是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com