
题目列表(包括答案和解析)
金属材料在生产生活中应用广泛。
(1)下列用品使用金属材料的是 (填字母序号)。 (2)自然界中的金属大多以化合物形式存在,获取金属单质的方法有多种。工业上用赤铁矿石冶炼铁的化学方程式为 ,这种冶炼方法叫还原法。铝的冶炼多采用电解法,通电分解熔融的氧化铝制取铝的化学方程式为 。
(2)自然界中的金属大多以化合物形式存在,获取金属单质的方法有多种。工业上用赤铁矿石冶炼铁的化学方程式为 ,这种冶炼方法叫还原法。铝的冶炼多采用电解法,通电分解熔融的氧化铝制取铝的化学方程式为 。
(3)珍惜和保护金属资源的措施之一是防止金属锈蚀,使用过的菜刀清洗后需要及时擦干放置,可以减少________对铁锈蚀的影响。
(4)回收废旧金属是保护金属资源的重要措施。化学小组的同学从电子垃圾中获得了含Cu 70%、Al 25%、Fe 4%及少量Au、Pt的电子废料,进行如下回收处理(省略分离操作和部分产品,流程以外的其他产品不含有上述元素)。回答有关问题:
①步骤c在加入固体G前应先除去溶液中的过氧化氢,除去过氧化氢的简单方法用化学方程式表示为 。
②滤液A中含有的溶质是 。
③A~J九种物质中,含有铁元素的是 (填字母序号)。
金属材料在生产生活中应用广泛。
(1)下列用品使用金属材料的是 (填字母序号)。
 (2)自然界中的金属大多以化合物形式存在,获取金属单质的方法有多种。工业上用赤铁矿石冶炼铁的化学方程式为
,这种冶炼方法叫还原法。铝的冶炼多采用电解法,通电分解熔融的氧化铝制取铝的化学方程式为 。
(2)自然界中的金属大多以化合物形式存在,获取金属单质的方法有多种。工业上用赤铁矿石冶炼铁的化学方程式为
,这种冶炼方法叫还原法。铝的冶炼多采用电解法,通电分解熔融的氧化铝制取铝的化学方程式为 。
(3)珍惜和保护金属资源的措施之一是防止金属锈蚀,使用过的菜刀清洗后需要及时擦干放置,可以减少________对铁锈蚀的影响。
(4)回收废旧金属是保护金属资源的重要措施。化学小组的同学从电子垃圾中获得了含Cu 70%、Al 25%、Fe 4%及少量Au、Pt的电子废料,进行如下回收处理(省略分离操作和部分产品,流程以外的其他产品不含有上述元素)。回答有关问题:
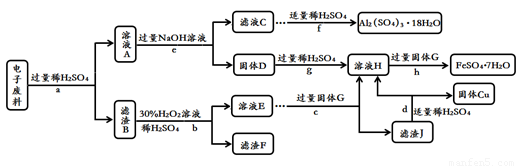
①步骤c在加入固体G前应先除去溶液中的过氧化氢,除去过氧化氢的简单方法用化学方程式表示为 。
②滤液A中含有的溶质是 。
③A~J九种物质中,含有铁元素的是 (填字母序号)。
 (2)自然界中的金属大多以化合物形式存在,获取金属单质的方法有多种。工业上用赤铁矿石冶炼铁的化学方程式为 ,这种冶炼方法叫还原法。铝的冶炼多采用电解法,通电分解熔融的氧化铝制取铝的化学方程式为 。
(2)自然界中的金属大多以化合物形式存在,获取金属单质的方法有多种。工业上用赤铁矿石冶炼铁的化学方程式为 ,这种冶炼方法叫还原法。铝的冶炼多采用电解法,通电分解熔融的氧化铝制取铝的化学方程式为 。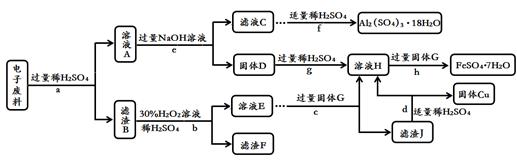




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com